题目内容
16.前四周期的元素X和Y与氧属于同一主族.元素X的电负性大于Y的电负性.(1)XO2分子中的X原子的杂化方式为sp2杂化,是极性(极性、非极性)分子.
(2)YO3的分子的空间构型为平面三角形.水溶液中酸性:H2X<H2Y(>、<、=.))
(3)向硫酸铜溶液中滴加氨水溶液中先生成蓝色沉淀,然后蓝色沉淀消失,溶液变为深蓝色,加入乙醇后,溶液中析出深蓝色晶体,写出该深蓝色晶体的化学式Cu(NH3)4SO4•H2O.
分析 由前四周期的元素X和Y与氧属于同一主族.元素X的电负性大于Y的电负性,所以X和Y分别是S、Se,
(1)SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,该分子为V形结构,所以硫原子采取sp2杂化,是极性分子;
(2)SeO3与三氧化硫是等电子体,中心原子Se采取sp3杂化,分子的空间构型为平面三角形,中心元素非金属性S>Se,共价键的强度H-S强于H-Se,所以酸性H2X<H2Y;
(3)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4•H2O.
解答 解:(1)SO2的价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,该分子为V形结构,所以硫原子采取SP2杂化,是极性分子,故答案为:sp2;极性;
(2)SeO3与三氧化硫是等电子体,中心原子Se采取SP3杂化,分子的空间构型为平面三角形,中心元素非金属性S>Se,共价键的强度H-S强于H-Se,所以酸性H2S<H2Se,故答案为:平面三角形;<;
(1)向深蓝色透明溶液加入乙醇,由于乙醇能降低溶解度,有利于晶体析出,所以[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,故会析出深蓝色的晶体:Cu(NH3)4SO4•H2O;
故答案为:Cu(NH3)4SO4•H2O;
点评 本题考查了配合物、价层电子对互斥理论的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
6.常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )
| A. | 17.8 mL | B. | 14.8 mL | C. | 12.6 mL | D. | 12.4 mL |
7.某阳离子${\;}_{Z}^{42}$X2+核外电子数为18,下列说法叙述正确的是( )
| A. | Z=18 | B. | X原子核内的中子数为20 | ||
| C. | Z=20 | D. | X原子核内的中子数为24 |
11.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是( )
| A. | 此电池工作时会发出蓝色火焰 | |
| B. | 燃料电池具有能量转化率高、可持续使用的优点 | |
| C. | 该电池的负极电极反应式为:2H2+4e-═4H+ | |
| D. | 该电池的正极电极反应式为:O2+2H2O+4e-═4OH- |
8.关于某溶液所含离子检验的方法和结论正确的是( )
| A. | 加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有SO42- | |
| B. | 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有Cl- | |
| C. | 加入盐酸产生能使澄清石灰水变浑浊的气体,原溶液中可能有CO32-或SO32- | |
| D. | 加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液是铵盐溶液 |
5.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
6.X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
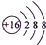
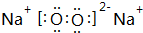 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键 ,名称是环己烷.
,名称是环己烷.