题目内容
15.如图所示虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物.填写下面空白: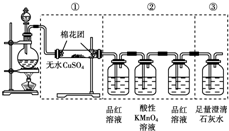
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.答关闭分液漏斗活塞,先用小火加热烧瓶,各集气瓶中有气泡冒出,停止加热之后,水会升到导管里形成一段水柱,证明装置不漏气.
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑.
(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是CO2、SO2;不能检出的物质是H2O.
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是H2O;不能检出的物质是CO2、SO2.
(5)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是CO2、SO2;不能检出的物质是H2O.
分析 (1)关键分液漏斗,用酒精灯加热烧瓶,根据各集气瓶中是否有气泡产生及停止加热后是否有水柱形成进行判断;
(2)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,据此写出反应的化学方程式;
(3)用无水硫酸铜来检验水的生成,用品红检验二氧化硫的生成,用澄清石灰水检验二氧化碳的生成,但是二氧化碳检验之前需要先把二氧化硫除净;
(4)二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊;
(5)将混合气体通过某种水溶液之后,再检验水的存在与否是错误的,因为这些水溶液中含有水.
解答 解:(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以通过以下操作判断装置气密性:关闭分液漏斗活塞,先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热之后,水会升到导管里形成一段水柱,证明装置不漏气,
故答案为:关闭分液漏斗活塞,先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热之后,水会升到导管里形成一段水柱,证明装置不漏气;
(2)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,反应的化学方程式为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑;
(3)如果将装置中①、②、③三部分仪器的连接顺序改为②可以检验并除去二氧化硫,①可以检验水的存在,但是不一定是混合气体中的水,③可以检验二氧化碳的存在,
故答案为:CO2、SO2;H2O;
(4)如果将仪器的连接顺序变为①、③、②,①可以确定水的存在,但是③既可以是二氧化碳的性质又可以是二氧化硫的性质,
故答案为:H2O;CO2、SO2;
(5)如果将仪器的连接顺序变为②、③、①,则②可以检出的物质是二氧化硫,并可以将二氧化硫除净,③检验出的事二氧化碳,但是①检验时一定会有水,这些水必要一定是原来混合气体中的水,
故答案为:CO2、SO2;H2O.
点评 本题考查学生浓硫酸的性质中的和碳单质的反应,题目难度中等,注意掌握浓硫酸的性质,明确产物检验所用的试剂以及检验的先后顺序,综合性较强,充分培养了学生的分析能力及化学实验能力.

| A. | 用碳棒作电极电解饱和MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | FeO溶于足量稀HNO3中:FeO+2H+═Fe2++H2O | |
| C. | 向苯酚钠溶液中通人少量CO2气体: +CO2+H2O→ +CO2+H2O→ ↓+CO32- ↓+CO32- | |
| D. | 向AlCl3溶液中加入过量氨水Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为
 .
.(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
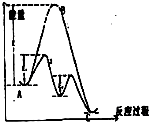
| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |