题目内容
20. 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
分析 相同温度下,根据“先拐先平数值大”知,P2>P1,增大压强C的含量升高,平衡正向移动,则0<x<2,为1;
相同压强下,根据“先拐先平数值大”知,T1>T2,升高温度,C的含量降低,平衡逆向移动,说明正反应是放热反应,所以该反应是一个反应前后气体体积减小、放热的可逆反应,结合图II分析解答.
解答 解:相同温度下,根据“先拐先平数值大”知,P2>P1,增大压强C的含量升高,平衡正向移动,则0<x<2,为1;
相同压强下,根据“先拐先平数值大”知,T1>T2,升高温度,C的含量降低,平衡逆向移动,说明正反应是放热反应,所以该反应是一个反应前后气体体积减小、放热的可逆反应,
A.P3>P4,相同温度下,增大压强,平衡正向移动,混合气体的物质的量减少,其平均摩尔质量增大;升高温度,平衡逆向移动,物质的量增大,平均摩尔质量减小,所以符合图象,故A正确;
B.无论反应是否达到平衡状态,混合气体质量不变、容器体积不变,则密度始终不变,与图象不符合,故B错误;
C.相同压强下,升高温度平衡逆向移动,A2的浓度升高,与图象不符合,故C错误;
D.P3<P4,相同温度下,增大压强平衡正向移动,A2的转化率增大,与图象不符合,故D错误;
故选A.
点评 本题考查图象分析,为高频考点,侧重考查学生分析判断能力,正确判断反应特点是解本题关键,再结合外界条件对平衡移动影响分析解答,易错选项是B.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中:c(Na+)>c(A--) | |
| B. | 酸性溶液中水的电离程度一定比纯水的电离程度小 | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液c(NaOH)<c(CH3COONa<c((Na2CO3 | |
| D. | 室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后,pH大于7 |
17.下列离子方程式不正确的是( )
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
5.下列离子能大量共存,通入足量SO2后,所含离子仍能大量共存的是( )
| A. | NH4+、Al3+、SO42-、AlO2- | B. | Na+、SO32-、Cl-、K+ | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | K+、I-、Cl-、NO3- |
9.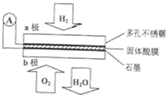 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |
10.能用来分离Fe3+和Al3+离子的试剂是( )
| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
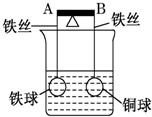 如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)