题目内容
5. C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.
C60、N60为新发现的有特殊用途的单质、分子结构均如图所示.研究表明,C60、N60分子中所有均达到8电子稳定结构.(1)C60分子中π键与α键个数之比为1:3,1molC60分之中共用电子对数目为120NA.
(2)C60不完全燃烧时可得到CO,则CO的结构式为C≡O,一氧化二氮的等电子体是CO2,它不能(填“能”或“不能”)溶于水.
分析 (1)C60分子中所有均达到8电子稳定结构,则每个碳原子周围要形成4对共用电子对,根据结构图可知,每个碳周围只有3个共价键,则应为两个单键和一个双键,据此答题;
(2)等电子体是指两个原子数和价电子数都相等的微粒,CO与氮气互为等电子体,可以根据氮气的结构确定CO的结构式,一氧化二氮的等电子体是二氧化碳,根据相似相溶原理判断.
解答 解:(1)C60分子中所有均达到8电子稳定结构,则每个碳原子周围要形成4对共用电子对,根据结构图可知,每个碳周围只有3个共价键,则应为两个单键和一个双键,双键中一个是π键,一个是α键,单键都是α键,所以C60分子中π键与α键个数之比为1:3,1molC60分之中共用电子对数目为$60×4×\frac{1}{2}$NA=120NA,
故答案为:1:3;120;
(2)等电子体是指两个原子数和价电子数都相等的微粒,互为等电子体的结构相似,CO与氮气互为等电子体,氮气的结构式为N≡N,所以CO的结构式为C≡O,一氧化二氮的等电子体是CO2,是非极性分子,根据相似相溶原理可一氧化二氮不能溶于水,
故答案为:C≡O;CO2;不能.
点评 本题主要考查共价键、等电子体等知识,难度不大,解题是注意充分运用题中信息,判断原子形成共用电子对情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称N、S、F;
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为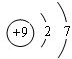 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
| A | C | |
| B |
(2)B位于元素周期表中第三周期,第ⅥA族;
(3)C的原子结构示意图为
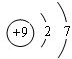 ,比较B、C的原子半径:B>C;
,比较B、C的原子半径:B>C;(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
10.现有8中元素的性质、数据如下表所列,它们属于第二或第三周期
回答下列问题:(用元素符号或化学式填写)
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:
(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为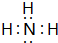 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:

(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为
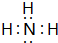 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
18.臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)?N2O5(g)+O2(g),在T温度下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列有关说法正确的是( )
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
19.在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 单位时间内生成0.5molA的同时,消耗1molC | |
| D. | V(C正):V(D正)=2:1 |
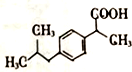

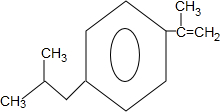 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$ .
.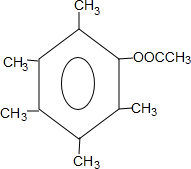 或
或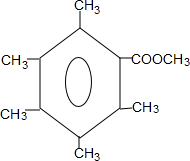 .
.