题目内容
18.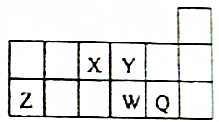 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
分析 根据元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素,结合元素周期律的递变规律解答该题.
解答 解:A、X为N,最低负价为-3,最高正价为+5,两者绝对值之和为8,故A正确;
B、电子层数越多,离子半径越大,具有相同排布的离子,原子序数大的离子半径小,故大小顺序为:W2->Q->Y2->Z3+,故B错误;
C、Y为O,O与H形成的双氧水中即含有O-H极性共价键,又含有O-O非极性共价键,故C错误;
D、N与Cl形成的最高价化合物中N最外层不满足8和电子的稳定结构,故D错误,故选A.
点评 本题考查位置结构性质的相互关系及应用,难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:下列说法正确的是( )
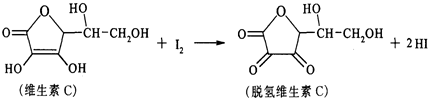

| A. | 上述反应为 取代反应 | |
| B. | 维生素C在酸性条件下水解只得到1种产物 | |
| C. | 滴定时可用淀粉溶液作指示剂 | |
| D. | 维生素C的分子式为C6H10O6 |
13.下列叙述中不正确的是( )
| A. | 只有放热的氧化还原反应才能设计成原电池,并将电能转化为化学能 | |
| B. | 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路 | |
| C. | 无论在原电池还是在电解池中,电子均不能通过电解质溶液 | |
| D. | 原电池的负极失去电子的总数等于正极得到电子的总数 |
9.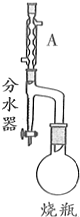 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:

实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
10.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 结构为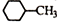 的一溴代物有5种 的一溴代物有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 |
 ;
; ;
;