题目内容
13.下列叙述中不正确的是( )| A. | 只有放热的氧化还原反应才能设计成原电池,并将电能转化为化学能 | |
| B. | 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路 | |
| C. | 无论在原电池还是在电解池中,电子均不能通过电解质溶液 | |
| D. | 原电池的负极失去电子的总数等于正极得到电子的总数 |
分析 A、根据原电池的构成条件及其能量转化知识来回答;
B、电解质溶液中阴、阳离子的定向移动,导线中为电子的定向移动;
C、电子不能通过溶液;
D、根据原电池的正负极得失电子守恒判断.
解答 解:A、原电池的构成条件之一为是自发的放热的氧化还原反应,原电池将化学能转化为电能的装置,故A错误;
B、电解质溶液中阴、阳离子的定向移动,导线中为电子的定向移动,所以电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路,故B正确;
C、电子不能通过溶液,所以无论在原电池还是在电解池中,电子均不能通过电解质溶液,故C正确;
D、因为原电池的正负极得失电子守恒,所以原电池的负极失去电子的总数等于正极得到电子的总数,故D正确.
故选A.
点评 本题考查电化学基础知识,比较基础,注意电解质溶液中阴、阳离子的定向移动,导线中为电子的定向移动,关键是对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.芜湖铁画是中国工艺美术百花园中的一朵奇葩,至今已有三百多年的历史.下列关于铁画生锈与防护的描述中不正确的是( )
| A. | 悬挂在干燥的环境中 | B. | 经常清扫表面的灰尘可以防止生锈 | ||
| C. | 表面涂漆防止生锈 | D. | 生锈时主要生成四氧化三铁 |
4.下列实验能达到目的是( )
| A. | 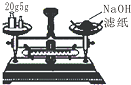 称量25g氢氧化钠 称量25g氢氧化钠 | B. | 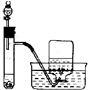 H2O2溶液制备O2 | C. | 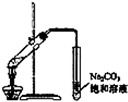 乙酸乙酯的制备 乙酸乙酯的制备 | D. | 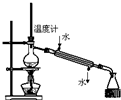 石油蒸馏 |
18.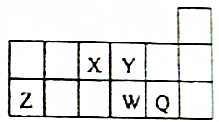 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
5.在溶液中能大量共存,若加入OH-就有沉淀析出,若加入H+就能放出气体的是( )
| A. | Mg2+、Na+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Al3+、NH4+、SO42- | D. | Na+、Cl-、Ca2+、HCO3- |
4.乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体,实验室制备乙酰苯胺反应原理和有关数据如下: NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$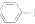
 +H2O
+H2O
实验步骤:
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离. ,
,
请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$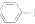
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离.
 ,
,请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.