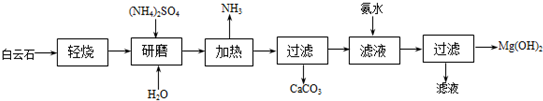
题目内容
3.我国月球探测工程现在处于研究阶段,目前正在为探测器“软”着陆月球做积极准备,探测器在发射前要加注常规燃料中的燃烧剂和氧化剂,已知A、B、C、D是原子序数依次增大的四种短周期元素,A元素组成的单质是上述资料中的“燃烧剂”,C元素的单质是上述资料中的“氧化剂”,A元素原子中没有中子,C元素最外层电子数是次外层的3倍,bB与cC两种元素存在关系:b=c-1,B、C形成的一种气态化合物呈红棕色,D元素的核外电子数比A、B、C三种原子核外电子总数还多一个,且A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一.请回答下列问题:
(1)D元素在元素周期表中的位置:第三周期第VIIA族;
(2)B原子的原子结构示意图:
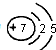 ;
;(3)A、B两种元素形成的四原子分子的电子式为
 ;
;(4)实验室制取D气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O.
分析 A元素原子中没有中子,且A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一,此强酸应为盐酸,即A为H元素,D为Cl元素;
C元素最外层电子数是次外层的3倍,次外层只能是2,那么最外层是6,那么C为O元素;
bB与cC两种元素存在关系:b=c-1,B、C形成的一种气态化合物呈红棕色,那么B为N元素;
A为H,B为N,C为O,核外电子总数=1+7+8=16,比D(17)少1,故满足题意,据此解答各小题即可.
解答 解:A元素原子中没有中子,且A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一,此强酸应为盐酸,即A为H元素,D为Cl元素;
C元素最外层电子数是次外层的3倍,次外层只能是2,那么最外层是6,那么C为O元素;
bB与cC两种元素存在关系:b=c-1,B、C形成的一种气态化合物呈红棕色,那么B为N元素;
经验证:A为H,B为N,C为O,核外电子总数=1+7+8=16,比D(17)少1,故推断正确;
(1)D为Cl,处于元素周期表中第三周期第VIIA族,故答案为:第三周期第VIIA族;
(2)B为N元素,原子序数为7,有2个电子层,最外层电子数为5,原子结构示意图为: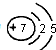 ,故答案为:
,故答案为: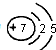 ;
;
(3)氨气中存在三对N-H共价键,电子式为: ,故答案为:
,故答案为: ;
;
(4)实验室是用二氧化锰和浓盐酸反应制氯气,反应生成氯气、二氯化锰、水,依据离子方程式书写方法,易溶于水的强电解质拆成离子,离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O.
点评 本题考查了制取氯气实验相关内容的探究,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累,题目难度中等.

①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
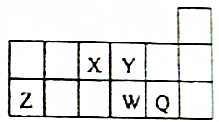 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).若保持温度不变,增加水蒸气的浓度,则K将不变(填“增大”、“减小”、“不变”)
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1<300℃(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$N2+6H2O.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是负极(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
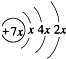 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.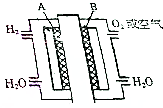 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;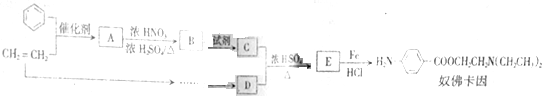
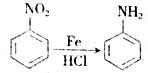
 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.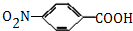 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.