题目内容
9.置换反应的通式可表示为: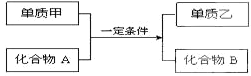
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为Cl2+2I-=I2+2Cl-;
(2)若过量的单质甲与化合物A发生反应的化学方程式为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ Al2O3+2Fe.除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是氢氧化钠溶液;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出用单质乙做碱性(KOH溶液)燃料电池反应物时的负极反应式2H2-2e-+2OH-=2H2O;
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 (1)若甲为黄绿色气体,应为Cl2,单质乙能使淀粉溶液变蓝色,则乙为I2,该反应可以是氯气与KI的反应;
(2)Al、氧化铝与氢氧化钠反应反应,而氧化铁不能与氢氧化钠溶液反应;
(3)单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,则甲为Fe、A为H2O、B为Fe3O4、乙为
H2,氢气做碱性(KOH溶液)燃料电池反应物,负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水;
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应为Mg在二氧化碳中燃烧生成MgO与碳.
解答 解:(1)若甲为黄绿色气体,应为Cl2,单质乙能使淀粉溶液变蓝色,则乙为I2,该反应可以是氯气与KI的反应,反应离子方程式为:Cl2+2I-=I2+2Cl-,
故答案为:Cl2+2I-=I2+2Cl-;
(2)Al、氧化铝与氢氧化钠反应反应,而氧化铁不能与氢氧化钠溶液反应,可以用氢氧化钠溶液除去反应后混合物中剩余的铝粉与生成的Al2O3,
故答案为:氢氧化钠溶液;
(3)单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,则甲为Fe、A为H2O、B为Fe3O4、乙为H2,氢气做碱性(KOH溶液)燃料电池反应物,负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:2H2-2e-+2OH-=2H2O,
故答案为:2H2-2e-+2OH-=2H2O;
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应为Mg在二氧化碳中燃烧生成MgO与碳,该反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查无机物推断,需要学生熟练掌握元素化合物性质,难度中等,注意铝热反应、镁在二氧化碳中的燃烧反应,在无机推断中经常考查.

| A. | 含K+为2mol的K2SO4溶液 | |
| B. | 将58.5gNaCl溶解于1L水中 | |
| C. | 将0.5mol/L的NaNO3溶液100mL加热蒸发掉50克水的溶液 | |
| D. | 将80gSO3溶于水并配成1L溶液 |
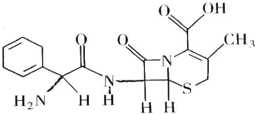 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  称量25g氢氧化钠 称量25g氢氧化钠 | B. |  H2O2溶液制备O2 | C. | 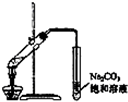 乙酸乙酯的制备 乙酸乙酯的制备 | D. | 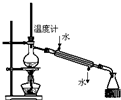 石油蒸馏 |
①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
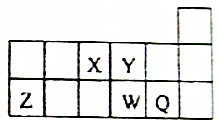 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |