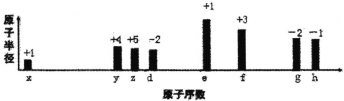
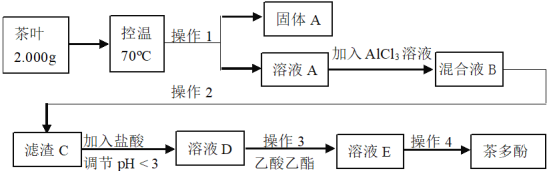
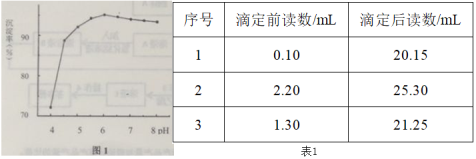
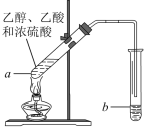
题目内容
【题目】某化学兴趣小组开展模拟工业合成氨的制备实验,在2 L密闭容器内,t℃时发生反应:N2 (g)+3 H2 (g) ![]() 2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) 上述反应在第5min时,N2的转化率为___________________ ;
(2) 用H2表示从0~2 min内该反应的平均速率v(H2)=______________________;
(3) t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为________________________(用字母填空,下同);
a.v(NH3)=0.05 mol L-1-min-1 b.v(H2)=0.03 mol L-1-min-1
c.v(N2)=0.02mol L-1-min-1 d.v(H2)=0.001 mol L-1- s -1
(4) 下列表述能作为上述实验中可逆反应N2 (g)+3 H2 (g) ![]() 2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
a. 反应速率v(N2):v(H2):v(NH3)=1:3:2
b. 各组分的物质的量浓度不再改变
c. 混合气体的平均相对分子质量不再改变
d. 混合气体的密度不变
e. 单位时间内生成n mol N2的同时,生成3n mol H2。
f. v(N2)消耗=2 v(NH3)消耗
g. 单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
(5) 下列措施不能使上述化学反应速率加快的是_____________。
a.及时分离出NH3气体 b.适当升高温度
c.增大N2的浓度 d.选择高效催化剂
【答案】70% 0.09mol/(L.min) a>c=d>b bc a
【解析】
(1)N2的初始物质的量0.20mol,第5min时,N2的物质的量为0.06mol,根据转化率公式,转化率=×100%计算;
(2)根据平均速率v(N2)=△C÷△t,v(H2)=3v(N2)计算;
(3)同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项,注意单位是否相同;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
N2的初始物质的量0.20mol,第5min时,N2的物质的量为0.06mol,已经转化的氮气的物质的量为:0.20mol0.06mol=0.14mol,反应在第5min时,N2的转化率=×100%=0.14mol÷0.2mol×100%=70%,
故答案为:70%;
N2的初始物质的量0.20mol,第2min时,N2的物质的量为0.08mol,从02min内已经转化的氮气的物质的量为:0.20mol0.08mol=0.12mol,平均速率v(N2)=△C÷△t=0.12mol÷2L÷2min=0.03mol/(Lmin),v(H2)=3v(N2)=0.09mol/(Lmin),
故答案为:0.09mol/(Lmin);
反应为N2 (g)+3 H2 (g) ![]() 2 NH3,以氢气的反应速率为标准进行判断;
2 NH3,以氢气的反应速率为标准进行判断;
a.V(NH3)=0.05mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.075mol/(Lmin);
b.ν(H2)=0.03mol/(Lmin);
c.ν(N2)=0.02mol/(Lmin),反应速率之比等于其计量数之比,所以ν(H2)=0.06mol/(Lmin);
d.ν(H2)=0.001mol/(Lmin)。
所以该反应进行快慢的顺序为a>c>b>d,
故答案为:a>c>b>d;
a.反应速率之比等于化学计量数之比,无论是否达到平衡状态都存在反应速率v(N2):v(H2):v(NH3)=1:3:2,不能用于判断是否破坏,故a错误;
b.各组分的物质的量浓度不再改变,可说明正逆反应速率相等,达到破坏状态,故b正确;
c.混合气体的平均相对分子质量不再改变,说明气体的总物质的量不变,可说明达到破坏状态,故c正确;
d.因气体的质量不变,容器的体积不变,则无论是否达到破坏,混合气体的密度都不变,故d错误;
e.单位时间内生成nmolN2的同时,生成3nmol H2,都为逆反应,不能说明正逆反应速率相等,故e错误;
f.2v(N2)消耗=v(NH3)消耗,说明正逆反应速率相等,v(N2)消耗=2v(NH3)消耗,不能说明正逆反应速率相等,故f错误;
g.单位时间内3molHH键断裂的同时2molNH键也断裂,正逆反应速率不等,没有达到破坏状态,故g错误;
故答案为:bc。
(5) a.及时分离出NH3气体,氨气的浓度降低,化学反应速率变慢,故a错误;
b.升高温度,化学反应速率加快,故b正确;
c.增大N2的浓度,提高化学反应速率,故c正确;
d.选择高效催化剂,可以加快化学反应速率。故d正确;
故选:c。
故答案为:c。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)
FeO(s)+H2(g),其平衡常数为K2,化学反应③CO2(g)+H2(g)![]() H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
H2O(g)+CO(g),其平衡常数为K3,在温度为973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系式_____,据此关系式及上表数据,也能推断出反应③是____(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中CO的浓度
(4)图甲、图乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲t2时刻改变的条件是___。②图乙t2时刻改变的条件是__。
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
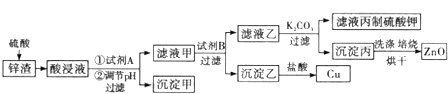
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .