题目内容
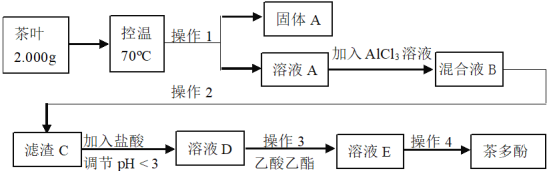
【题目】从茶叶中提取的茶多酚具有抗氧化、清除自由基,预防心血管疾病等多方面药理功能,是一种新型的无毒天然食品添加剂。茶多酚为淡黄至茶褐色粉状固体,其涩味,易溶于水、乙醇、乙酸乙酯,微溶于油脂,并能与某些金属离子反应形成沉淀。科研工作者提取茶多酚的一种工艺如下:
已知:
①收率指投入单位数量原料获得的实际产品产量与理论计算产品产量的比值。
②0.159g高锰酸钾能与2.91mg茶多酚反应完全。
请回答:
(1)下列说法正确的是:_____________。
A 将茶叶样品粉碎、控制温度均是为了加快速率,提高茶多酚的浸出率
B 操作1和2都是过滤,均需对滤渣进行洗涤且合并洗涤液
C 加入较高浓度的盐酸,会造成茶多酚的收率降低
D 操作4为真空干燥,其原理与蒸馏相似
(2)热水浸泡时间过长,温度过高均造成茶多酚的收率降低,原因是______。
(3)操作3为萃取分液,其实验过程如下,合理的操作步骤为___________。
①将分液漏斗放置于铁架台上,静置
②从上口倒出乙酸乙酯层
③将溶液D和乙酸乙酯分别加入到分液漏斗中
④检查分液漏斗是否漏水
⑤充分振荡并放气
⑥从下口放出下层溶液
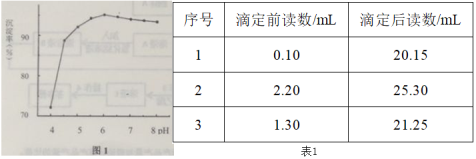
(4)研究发现,用AlCl3+ZnCl2的复合沉淀剂效果更理想。向溶液A中加入复合沉淀剂,常温下进行茶多酚沉淀,用0.1 mol·L-1的Na2CO3溶液调节pH。其他条件相同,不同pH时,测得茶多酚的沉淀率如图1,请结合图1,解释选择pH=6进行茶多酚沉淀的可能原因________。
(5)将溶液A定容至50 mL,每次取10.0 mL,用0.159 g·mL-1的高锰酸钾进行滴定,数据如下表1,则该次实验,测得茶叶中茶多酚的含量为_______mg·g-1。
【答案】AD 因茶多酚为一类多酚类化合物,易被氧气氧化,热水浸泡时间过长,相应的增加了茶多酚氧化,温度过高氧化速度加快 ④③⑤①⑥② pH值过低,沉淀不完全;pH值过高茶多酚更易被氧化 145.9
【解析】
茶叶粉碎、控制温度都是为了提高浸出率,再过滤,将过滤后的溶液加入氯化铝进行沉淀,过滤后将沉淀加入盐酸溶解,再用乙酸乙酯进行萃取,萃取后分离出茶多酚和乙酸乙酯。
⑴A选项,将茶叶样品粉碎、控制温度均是为了加快速率,提高茶多酚的浸出率,故A正确;
B选项,操作1和2都是过滤,操作1对滤渣洗涤并对洗涤液合并,操作2对滤渣进行洗涤,不需要洗涤液,只需要滤渣,故B错误;
C选项,滤渣C加入较高浓度的盐酸,pH值较低,滤渣C溶解得更充分,茶多酚的收率月多,吸收率越高,故C错误;
D选项,溶液E是茶多酚和乙酸乙酯的混合物,将两者分离开,操作4为真空干燥,分开的原理与蒸馏相似,故D正确;故答案为AD。
⑵茶多酚为一类多酚类化合物,在空气中易被氧气氧化,热水浸泡时间过长,相应的增加了茶多酚氧化,温度过高氧化速度加快热水浸泡时间过长,因此温度过高均造成茶多酚的收率降低,原因是因茶多酚为一类多酚类化合物,易被氧气氧化,热水浸泡时间过长,相应的增加了茶多酚氧化,温度过高氧化速度加快,故答案为:因茶多酚为一类多酚类化合物,易被氧气氧化,热水浸泡时间过长,相应的增加了茶多酚氧化,温度过高氧化速度加快。
⑶操作3为萃取分液,先检漏,再将液体分别倒入到分液漏斗中,再振荡,振荡过程中要放气,再将分液漏斗静止在铁架台上,再将下层液体从下口放出,上层液体从上口倒出,因此操作顺序为④③⑤①⑥②,故答案为:④③⑤①⑥②。
⑷向溶液A中加入复合沉淀剂,常温下进行茶多酚沉淀,用0.1 mol·L-1的Na2CO3溶液调节pH。pH值过低,酸性较强,则茶多酚沉淀可能不完全,pH值过高茶多酚更易被氧化,因此选择pH=6进行茶多酚沉淀的可能是pH值过低,沉淀不完全,pH值过高茶多酚更易被氧化,故答案为:pH值过低,沉淀不完全,pH值过高茶多酚更易被氧化。
⑸根据数据分析,第2个数据是错误的数据,只能按1、3两个数据进行计算,平均值为20.05 mL,则消耗的高锰酸钾的质量为0.159 g·mL-1×20.05 mL ×5 = 0.159 ×100.25 g,根据0.159g高锰酸钾能与2.91mg茶多酚反应完全,则茶多酚的质量2.91mg×100.25=291.7275mg,则茶叶中茶多酚的含量为![]() ,故答案为145.9 mg·g-1。
,故答案为145.9 mg·g-1。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】某化学兴趣小组开展模拟工业合成氨的制备实验,在2 L密闭容器内,t℃时发生反应:N2 (g)+3 H2 (g) ![]() 2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) 上述反应在第5min时,N2的转化率为___________________ ;
(2) 用H2表示从0~2 min内该反应的平均速率v(H2)=______________________;
(3) t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为________________________(用字母填空,下同);
a.v(NH3)=0.05 mol L-1-min-1 b.v(H2)=0.03 mol L-1-min-1
c.v(N2)=0.02mol L-1-min-1 d.v(H2)=0.001 mol L-1- s -1
(4) 下列表述能作为上述实验中可逆反应N2 (g)+3 H2 (g) ![]() 2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
a. 反应速率v(N2):v(H2):v(NH3)=1:3:2
b. 各组分的物质的量浓度不再改变
c. 混合气体的平均相对分子质量不再改变
d. 混合气体的密度不变
e. 单位时间内生成n mol N2的同时,生成3n mol H2。
f. v(N2)消耗=2 v(NH3)消耗
g. 单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
(5) 下列措施不能使上述化学反应速率加快的是_____________。
a.及时分离出NH3气体 b.适当升高温度
c.增大N2的浓度 d.选择高效催化剂