��Ŀ����
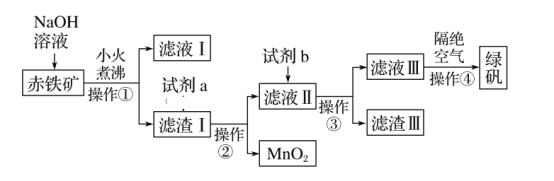
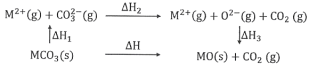
����Ŀ����ҵ�����г�����п����������ZnO��FeO��Fe2O3��CuO�����ʣ�����ȡ����п�ͽ���ͭ�ȣ�����Ҫ����������ͼ��ʾ��
�й��������↑ʼ�����ͳ�����ȫ��pH���±�
�������� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | Zn��OH��2 |
��ʼ������pH | 1.5 | 6.5 | 5.4 | 6.5 |
������ȫ��pH | 3.7 | 9.7 | 6.7 | 8.0 |
��1��Ϊ��߽������ʣ����ʵ���������Ũ���⣬���ɲ�ȡ�Ĵ�ʩ�У�д�������� ______
��2���Լ�A�� ______ ���ѧʽ����
��3���������Һ��pH�ķ�Χ�� ______.
��4����Һ�����Լ�B�����û���Ӧ�����Լ�B�� ______ ���ѧʽ����
��5����ʵ���ҽ��б���ʱ��ʢ�ų����������������� ______ ��
���𰸡����衢�ʵ����¡���������ϸ�ɷ�ĩ H2O2 3.7��5.4 Zn ����
��������
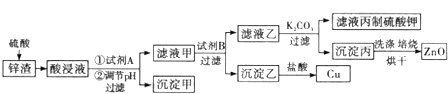
ZnO��FeO��Fe2O3��CuO�����ᷴӦ��������п�������������������Լ�����ͭ����������ͼ�������Լ�A��Ŀ���ǽ����������������������ӣ����ڳ��������A����Ϊ˫��ˮ��˫��ˮ����������������Ϊ���������ӣ�����pHʹFe(OH)3��ȫ������������Ϊ����������Ϊ�˲����������ʣ������Լ�B���û���ͭ����BΪп��������ͭ��Ӧ�õ�ͭ���ʣ���Һ��Ϊ���������п������̼��أ������ᷴӦ��������أ�ͬʱ�õ�������̼��п�����յõ�����п���ݴ˷������
(1)���衢�ʵ����¡���������ϸ�ɷ�ĩ�ɼӿ췴Ӧ���ʣ��ʴ�Ϊ�����衢�ʵ����¡���������ϸ�ɷ�ĩ��
(2)˫��ˮ����������ӷ�Ӧ�����ӷ���ʽΪ��H2O2+2Fe2++2H+=2Fe3++2H2O��ʹ��Ԫ�����׳������Ҳ������µ����ʣ��ʴ�Ϊ��H2O2��
(3)ʹFe(OH)3��ȫ�������������Ӳ����������ݱ������ݣ��������Һ��pH�ķ�ΧΪ��3.7��5.4���ʴ�Ϊ��3.7��5.4��
(4)��������������BΪп���ʴ�Ϊ��Zn��
(5)���չ������������ʴ�Ϊ��������

����Ŀ��ij��ѧ��ȤС�鿪չģ�ҵ�ϳɰ����Ʊ�ʵ�飬��2 L�ܱ������ڣ�t��ʱ������Ӧ��N2 (g)+3 H2 (g) ![]() 2 NH3 (g)������ϵ�У�n(N2)��ʱ��ı仯���±���
2 NH3 (g)������ϵ�У�n(N2)��ʱ��ı仯���±���
ʱ��(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2�����ʵ���(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) ������Ӧ�ڵ�5minʱ��N2��ת����Ϊ___________________ ��
(2) ��H2��ʾ��0��2 min�ڸ÷�Ӧ��ƽ������v(H2)=______________________��
(3) t��ʱ����4����Ϊ2L�ܱ������в�ͬͶ���½��кϳɰ���Ӧ����������ͬʱ���ڲⶨ�Ľ�����жϸ÷�Ӧ���п�����˳��Ϊ________________________(����ĸ��գ���ͬ)��
a��v(NH3)=0.05 mol L-1-min-1 b��v(H2)=0.03 mol L-1-min-1
c��v(N2)=0.02mol L-1-min-1���� ���� d��v(H2)=0.001 mol L-1- s -1
(4) ���б�������Ϊ����ʵ���п��淴ӦN2 (g)+3 H2 (g) ![]() 2 NH3 (g) �ﵽ��ѧƽ��״̬�ı�־��_________________________ ��
2 NH3 (g) �ﵽ��ѧƽ��״̬�ı�־��_________________________ ��
a. ��Ӧ����v(N2)��v(H2)��v(NH3)=1��3��2
b. ����ֵ����ʵ���Ũ�Ȳ��ٸı�
c. ��������ƽ����Է����������ٸı�
d. ���������ܶȲ���
e. ��λʱ��������n mol N2��ͬʱ������3n mol H2��
f. v(N2)����=2 v(NH3)����
g. ��λʱ����3mol H��H�����ѵ�ͬʱ2mol N��H��Ҳ����
(5) ���д�ʩ����ʹ������ѧ��Ӧ���ʼӿ����_____________��
a����ʱ�����NH3���� b���ʵ������¶�
c������N2��Ũ�� d��ѡ���Ч����
����Ŀ��п��ԭ���Ȼ�����һ����������Ӧ��ǰ�����Ʊ���ķ��������Ʊ�����ʾ��ͼ���£�
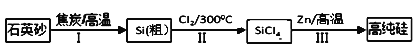
��1��1mol��̿�ڹ��̢���ʧȥ____mol���ӡ�
��2�����̢���Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����Ʊ�Cl2�����ӷ���ʽΪ________��
��3�����裨2���еĵ������У����ü״�ȼ�ϵ������Դ����KOH������ʣ�������ӦΪ_________��
��4�������������̱����ϸ������ˮ���ش��������⣺
��SiCl4��ˮ����ˮ������SiO2��һ���ᣬ��ѧ��Ӧ����ʽΪ_________��
�ڸ���Cl2ʱ�������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ��ǣ��轫Լ90��ij�ʪ��������ȴ��12�棬Ȼ����ͨ��ŨH2SO4�С���ȴ��������_________��
��5��Zn��ԭSiCl4�Ŀ��淴Ӧ���£�
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)��H��0����˵����ȷ������___��
Si(S)+2ZnCl2(g)��H��0����˵����ȷ������___��
A����ԭ�������������������н��� |
B��Ͷ��1molZn������14g��ԭ���� |
C������SiCl4(g)�������÷�Ӧƽ�ⳣ������ |
D����SiCl4(g)������������H��ֵ |
��6����һ���ɹ������IJ����г�����Ag2SO4 ����֪ij�¶���Ag2SO4��M��312g/mol�����ܽ��Ϊ0.624g/100g H2O�����¶���Ag2SO4��Ksp��_______����λ��Ч���֣���