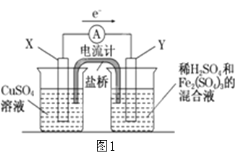
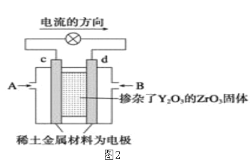
题目内容
【题目】分子中存在π 键,且碳原子全部以sp杂化轨道成键的是( )
A. CH3CH3B. CH2=CH2C. CH≡CHD. ![]()
【答案】C
【解析】
共价双键或三键中含有π键,中心原子是sp杂化说明中心原子含有2个σ键且不含孤电子对,据此分析解答。
A.乙烷分子中碳原子含有4个共价单键不含共价双键或三键,不存在π 键,且碳原子采用sp3杂化,故A错误;
B.乙烯分子中每个碳原子含有3个σ键,1个碳碳双键,分子中含有一个π键,碳原子采用sp2杂化,故B错误;
C.乙炔分子中每个碳原子含有2个σ键,含有碳碳三键,分子中含有2个π键,碳原子采用sp杂化,故C正确;
D.苯分子中含有一个大π键,每个碳原子含有3个σ键,碳原子采用sp2杂化,故D错误;
故选C。

【题目】某化学兴趣小组开展模拟工业合成氨的制备实验,在2 L密闭容器内,t℃时发生反应:N2 (g)+3 H2 (g) ![]() 2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) 上述反应在第5min时,N2的转化率为___________________ ;
(2) 用H2表示从0~2 min内该反应的平均速率v(H2)=______________________;
(3) t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为________________________(用字母填空,下同);
a.v(NH3)=0.05 mol L-1-min-1 b.v(H2)=0.03 mol L-1-min-1
c.v(N2)=0.02mol L-1-min-1 d.v(H2)=0.001 mol L-1- s -1
(4) 下列表述能作为上述实验中可逆反应N2 (g)+3 H2 (g) ![]() 2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
a. 反应速率v(N2):v(H2):v(NH3)=1:3:2
b. 各组分的物质的量浓度不再改变
c. 混合气体的平均相对分子质量不再改变
d. 混合气体的密度不变
e. 单位时间内生成n mol N2的同时,生成3n mol H2。
f. v(N2)消耗=2 v(NH3)消耗
g. 单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
(5) 下列措施不能使上述化学反应速率加快的是_____________。
a.及时分离出NH3气体 b.适当升高温度
c.增大N2的浓度 d.选择高效催化剂