题目内容
【题目】八种短周期元素原子半径的相对大小、最高正价或最低负价如图所示,下列说法错误的是()
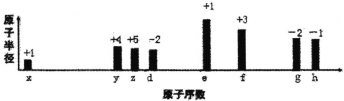
A.常见的离子半径:g>h>d>e
B.氢化物的沸点y 一定低于z
C.由d、e、g三种元素组成的盐和稀硫酸反应可能生成沉淀
D.e、f、h的最高价氧化物的水化物之间可两两反应
【答案】B
【解析】
从图中的化合价、原子半径的大小及原子序数,x位于第一周期,为H元素;y、z、d位于第二周期,y是C元素,z是N元素,d是O元素;e、f、g、h位于第三周期,是Na元素,f是Al元素,g是S元素,h是Cl元素,据此结合元素周期律知识解答。
根据分析可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;
A.电子层越多离子半径越大,电子层相同时,核电荷数越大离子半径越小,则离子半径:g>h>d>e,故A正确;
B.NH3分子间形成氢键,其沸点比CH4高,但C的氢化物有很多种,且多碳的烃常温下可能为液态或固态,则C的氢化物沸点不一定就比N的氢化物低,故B错误;
C.O、Na、S形成的硫代硫酸钠与稀硫酸反应可以生成S沉淀,故C正确;
D.氢氧化铝具有两性,能够与NaOH、高氯酸反应,故D正确;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组开展模拟工业合成氨的制备实验,在2 L密闭容器内,t℃时发生反应:N2 (g)+3 H2 (g) ![]() 2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) 上述反应在第5min时,N2的转化率为___________________ ;
(2) 用H2表示从0~2 min内该反应的平均速率v(H2)=______________________;
(3) t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为________________________(用字母填空,下同);
a.v(NH3)=0.05 mol L-1-min-1 b.v(H2)=0.03 mol L-1-min-1
c.v(N2)=0.02mol L-1-min-1 d.v(H2)=0.001 mol L-1- s -1
(4) 下列表述能作为上述实验中可逆反应N2 (g)+3 H2 (g) ![]() 2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
a. 反应速率v(N2):v(H2):v(NH3)=1:3:2
b. 各组分的物质的量浓度不再改变
c. 混合气体的平均相对分子质量不再改变
d. 混合气体的密度不变
e. 单位时间内生成n mol N2的同时,生成3n mol H2。
f. v(N2)消耗=2 v(NH3)消耗
g. 单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
(5) 下列措施不能使上述化学反应速率加快的是_____________。
a.及时分离出NH3气体 b.适当升高温度
c.增大N2的浓度 d.选择高效催化剂