题目内容
14. 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(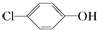 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
分析 原电池工作时,阳离子向正极移动,则A是正极,正极上发生得电子的还原反应: +2e-+H+═
+2e-+H+═ -OH+Cl-,B为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
-OH+Cl-,B为负极,反应:CH3COO--8e-+2H2O=2CO2+7H+,以此解答该题.
解答 解:A.由氢离子的定向移动可知A为正极,B为负极,故A正确;
B.由示意图可知质子从B极移向A极,故B错误;
C.B为负极,发生氧化反应,电极方程式为CH3COO--8e-+2H2O=2CO2+7H+,故C正确;
D.由电极方程式可知当转移8mol电子时,正极消耗4molH+,负极生成7molH+,则处理后的废水pH降低,故D正确.
故选B.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
相关题目
18.分子式为C3H4Cl2的链状有机物有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
5.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值产品是目前的研究目标.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
①此温度下该反应的平衡常数K=64.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.

(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分物质的量如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ.mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3 kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂.可以将CO2和CH4直接转化为成乙酸.
①在不同温度下催化剂的催化效果与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是缩小体积增大压强或增大CO2的浓度.
(3)①Li2O、Na2O、MgO均能吸收CO2.如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,写出CO2和Li4SiO4反应的化学方程式CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3.

(4)反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO2+H2+O2利用反应A可将释放的CO2转化为具有工业利用价值的产品.高温电解技术能高效实现反应A,工作原理示意图如图2.CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
9.下列递变情况中,正确的是( )
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
6.下列说法正确的是( )
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 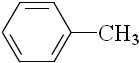 、 、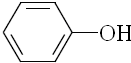 和 和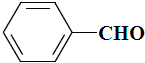 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是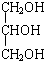 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| B. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.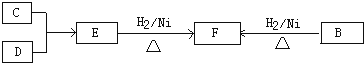
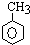 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$
 _
_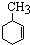
 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.