题目内容
1.已知:弱酸HX(aq)与NaOH(aq)反应的中和热△H=-12.1kJ•mol-1; HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1.则HX在水溶液中电离的△H 等于( )| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
分析 写出两个中和反应的热化学方程式,然后利用盖斯定律进行计算,将已知两个热化学方程式相减得到HX在水溶液中电离的电离方程式,同时反应热也随之相减,可得HX在水溶液中电离的反应热.
解答 解:弱酸HX(aq)与NaOH(aq)反应的中和热△H=-12.1kJ•mol-1,可得热化学方程式:HX(aq)+OH-(aq)═X-(aq)+H2O(l)△H=-12.1kJ•mol-1…①
HCl(aq)与NaOH(aq)反应的中和热△H=-55.6kJ•mol-1,可得热化学方程式:H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ•mol-1…②
HX电离方程式为:HX?H++X-,
根据盖斯定律①-②可得HX电离的热化学方程式为:HX(aq)?H+(aq)+X-(aq)△H=-12.1kJ•mol-1-(-55.6kJ•mol-1)=+43.5kJ•mol-1,
故选A.
点评 本题考查了盖斯定律在反应热的计算中的应用,题目难度中等,明确盖斯定律的含义及热化学方程式书写原则为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
12.下列说法正确的是( )
| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |
9.下列递变情况中,正确的是( )
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
6.下列说法正确的是( )
| A. | 油脂、糖类和蛋白质是三大营养物质,都能发生水解;被称作“人体核武器”的维生素B2含有肽键结构等,也能发生水解 | |
| B. | 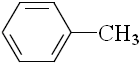 、 、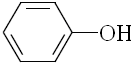 和 和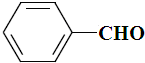 ,仅第一种能使KMnO4酸性溶液褪色 ,仅第一种能使KMnO4酸性溶液褪色 | |
| C. | 氨基酸主要以内盐形式存在,调节溶液的pH不可改变它在水中的溶解度 | |
| D. | 体检报告单中的“甘油三酯”是甘油的衍生物,其中甘油结构简式是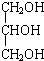 |
13.下列离子方程式书写正确的是( )
| A. | 用食醋除去热水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Cl2溶于水:Cl2+H2O═H++Cl-+HClO | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
10.以CaCO3、海水等为原料,可以制备一系列物质,如图所示.下列说法正确的是( )
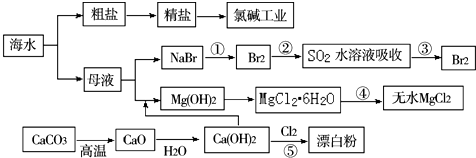

| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
11.下列有关物质的性质与应用对应关系不正确的是( )
| A. | 常温下,铁与浓硝酸发生钝化,常用铁罐车运输浓硝酸 | |
| B. | SO2有漂白性,常用它来漂白纸浆 | |
| C. | 硅酸钠溶液呈碱性,常用做木材的防火剂 | |
| D. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 |