题目内容
16.现代科技的高度快速发展离不开C和Si元素.(1)写出Si的基态原子核外电子排布式1s22s22p63s23p2.
(2)从电负性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为O>C>Si.
(3)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为sp3,微粒间存在的作用力是共价键.
(4)C、Si为同一主族的元素,CO2、SiO2的化学式相似,但结构和性质有很大的不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:Si原子比C原子半径大,Si、O原子间距离较大,P-P轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
分析 (1)Si的原子核外有14个电子分三层排布;
(2)同周期从左到右非金属性增强,同主族从上到下非金属性减弱;
(3)SiC中每个C原子形成4个共价键,价层电子对数为4;
(4)Si原子比C原子半径大,Si、O原子间距离较大.
解答 解:(1)Si的原子核外有14个电子分三层排布,则其电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)同周期从左到右非金属性增强,则非金属性:O>C,同主族从上到下非金属性减弱,则非金属性:C>Si,所以非金属性:O>C>Si,
故答案为:O>C>Si;
(3)SiC中每个C原子形成4个共价键,价层电子对数为4,则C原子的杂化方式为sp3;SiC中C原子与Si原子之间以共价键结合,故答案为:sp3;共价键;
(4)CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键,是因Si原子比C原子半径大,Si、O原子间距离较大,P-P轨道肩并肩重叠程度较小,不能形成上述稳定的π键,
故答案为:Si原子比C原子半径大,Si、O原子间距离较大,P-P轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
点评 本题考查了核外电子排布、非金属性比较、杂化类型、共价键等,综合性较强,难度中等,注意把握非金属性的比较方法以杂化类型的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列分离方法中,正确的是( )
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
4.氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是( )
| A. | BH3 | B. | SiH4 | C. | C2H2 | D. | NaH |
11.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | C2F4 CH3Cl | B. | CO2 C2H2 | C. | C60 S8 | D. | NH3 PH3 |
1.下列物质的性质与应用对应关系不正确的是( )
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
5.根据下表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO->CO32->F- | |
| C. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ | |
| D. | 次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO |
6.下列叙述错误的是( )
| A. | 13C和14C互为同位素 | B. | 1H和2H是不同的核素 | ||
| C. | 6Li和7Li的电子数相等 | D. | 14C和14N属于同种元素 |
 ,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应.
,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.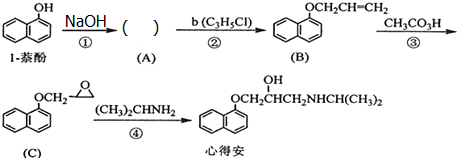
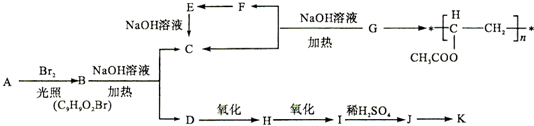
 .
.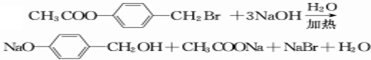 .
.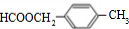 .
.