题目内容
18.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
分析 T、X、Y、Z四种短周期元素,M层电子数比K层电子数多4个,则T有3个电子层,最外层电子数为6,则T为S元素;X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素,据此解答.
解答 解:T、X、Y、Z四种短周期元素,M层电子数比K层电子数多4个,则T有3个电子层,最外层电子数为6,则T为S元素;X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素,
(1)T为S元素,三个电子层,所以三个周期,原子最外层有6个电子,所以T是第三周期,第ⅥA元素,硫离子的结构示意图为 ,与故答案为:三;ⅥA;
,与故答案为:三;ⅥA; ;
;
(2)元素Y是氮与氢元素形成一种离子NH4+,铵根离子易水解而使其溶液呈酸性,其水解反应方程式为:NH4++H2O?NH3.H2O+H+,故答案为:NH4++H2O?NH3.H2O+H+;
(3)同周期自左而右非金属性减弱,Cl元素非金属性较强,
a.物理性质不能说明非金属性强弱,故a错误;
b.氢化物越稳定,中心元素的非金属性越强,故b正确;
c.与氢氧化钠溶液反应不能说明非金属性强弱,如氧气不能与氢氧化钠溶液反应,非金属性O>S,故c错误;
故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3.
点评 本题考查结构性质位置关系、核外电子排布规律、元素周期律等,难度不大,推断元素是解题关键,注意基础知识的理解掌握.

| A. | 在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有氧化性 | |
| B. | 久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,再将该溶液滴入NaOH溶液,变红,说明酚酞易溶于酒精 | |
| C. | 在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2浊液并加热,无红色沉淀,说明淀粉未水解 | |
| D. | 检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液 |
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | 以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜 | |
| C. | 除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可 | |
| D. | 加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32- |
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
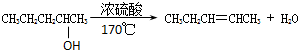 消去反应
消去反应 取代反应
取代反应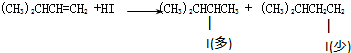 加成反应
加成反应 取代反应
取代反应