题目内容
13.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)=c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
分析 硫化钠溶液中,硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),氢氧根离子来自水的电离和硫离子的水解,则c(OH-)>c(HS-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);硫化钠溶液中还存在电荷守恒c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)、物料守恒c(Na+)=2c(HS-)+2c(H2S)+2c(S2-)、质子守恒c(OH-)=c(HS-)+c(H+)+2 c(H2S),据此进行判断.
解答 解:A.硫离子部分水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(S2-),氢氧根离子来自水的电离和硫离子的水解,则c(OH-)>c(HS-),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故A正确;
B.硫化钠水溶液中存在电荷守恒,阳离子所带正电荷的浓度和等于阴离子所带的负电荷的浓度和,即:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C.硫化钠水溶液中存在物料守恒,钠元素和硫元素物质的量之比为2:1,溶液中物料守恒为:c(Na+)=2 c(S2-)+2 c(HS-)+2 c(H2S),故C错误;
D.硫化钠水溶液中存在质子守恒:c(OH-)=c(HS-)+c(H+)+2 c(H2S),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒、质子守恒的含义及应用方法为解答关键,注意熟练掌握判断离子浓度大小的方法.

练习册系列答案
相关题目
4.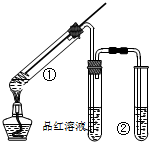 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
1.以下实验方法肯定错误的是( )
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
8.用铂(惰性)电极进行电解,下列说法中正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
5.下列叙述错误的是( )
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
2.有机物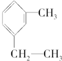 用系统命名法命名为( )
用系统命名法命名为( )
 用系统命名法命名为( )
用系统命名法命名为( )| A. | 间甲乙苯 | B. | 1,3-甲乙苯 | ||
| C. | 1-甲基-3-乙基苯 | D. | 1-甲基--5-乙基苯 |
3.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①观察颜色;②石蕊试剂;③品红溶液( )
| A. | ①②③ | B. | 只有①③ | C. | 只有②③ | D. | 只有① |