题目内容
3.下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是( )| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
分析 A.乙醇燃烧所有的氢元素均生成水;
B.根据乙醇和金属钠反应的实质来回答;
C.1个乙醇分子中含有一个氧原子,不能说明乙醇分子中有一个氢原子与其他氢原子不同;
D.乙醇溶于水的过程不发生化学反应,乙醇与水能形成氢键.
解答 解:A.乙醇燃烧所有的氢元素均生成水,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故A错误;
B.1mol乙醇跟足量的Na作用得0.5molH2,很明显乙醇中的6个氢只有一个能变为氢气,这个氢与其他氢不同,故B正确;
C.CH3OCH3分子中含有一个氧原子,但1个分子中6个氢原子相同,所以1个乙醇分子中含有一个氧原子,不能说明乙醇分子中有一个氢原子与其他氢原子不同,故C错误;
D.乙醇与水能形成氢键,故乙醇与水能以任意比互溶,不能证明乙醇分子中有一个氢原子与另外氢原子不同,故D错误;
故选B.
点评 本题考查乙醇中羟基的性质以及乙醇的结构知识,题目难度不大.注意从结构考虑物质的性质.

练习册系列答案
相关题目
13.保护环境是每一个公民的责任,下列做法不利于保护环境的是( )
| A. | 城市垃圾分类处理 | B. | 推广使用清洁能源 | ||
| C. | 过量使用化肥、农药 | D. | 推广使用无氟冰箱 |
11.同一周期的4种元素,原子半径从小到大的顺序为C<A<D<B(不包括稀有气体元素),则最有可能形成共价化合物的是( )
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
8.下列处理方法和变化不属于化学变化的是( )
| A. | 用食醋蒸熏对房间消毒杀菌 | |
| B. | SO2通入品红中溶液变为无色 | |
| C. | 红糖水中加入活性炭溶液变为无色 | |
| D. | 少量胆矾粉末加入到浓硫酸中固体变白色 |
15.化学反应H2+Cl2═2HCl的能量变化如图所示,则下列说法正确的是( )
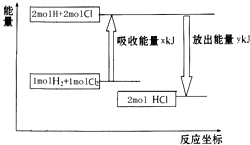

| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
12.R、X、Y、Z、Q、W是六种原子序数依次增大的短周期元素,其相关信息如下表:
(1)Y的元素名称氮,它在元素周期表中位置是第2周期,第VA族;
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是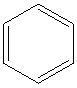 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂. 
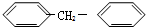

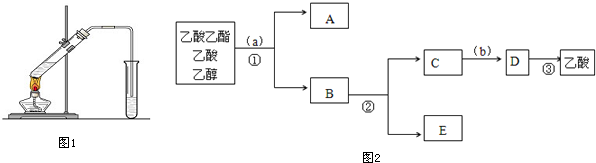
 $\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$
$\stackrel{反应1}{→}$X$\stackrel{反应2}{→}$Y$\stackrel{反应3}{→}$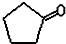
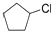
 .
.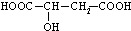
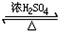 CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O
CH3CH2OOC-CHOH-CH2COOCH2CH3+2H2O