题目内容
10.下列物质的提纯或离子检验的方法正确的是( )| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | 以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜 | |
| C. | 除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可 | |
| D. | 加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32- |
分析 A.胶体不能透过半透膜;
B.精炼铜时,粗铜为阳极,精铜为阴极;
C.加入过量KOH,引入新杂质;
D.CO32-、SO32-、HCO3-等加入氢氧化钙溶液都可生成沉淀.
解答 解:A.胶体不能透过半透膜,可用渗析的方法分离胶体和溶液,故A正确;
B.精炼铜时,粗铜含有金、银、铁、锌等,粗铜应为阳极,铁、锌首先被氧化,精铜为阴极,在阴极只析出铜,故B错误;
C.加入过量KOH,引入新杂质,故C错误;
D.CO32-、SO32-、HCO3-等加入氢氧化钙溶液都可生成沉淀,应加入氯化钙和盐酸检验,故D错误.
故选A.
点评 本题考查物质的分离、提纯以及物质的检验,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,注意实验方案的合理性和可行性的评价,难度不大.

练习册系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
1.以下实验方法肯定错误的是( )
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
5.下列叙述错误的是( )
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 分子式为C5H12的有机物有三种,它们属于同分异构体 |
15.化学反应H2+Cl2═2HCl的能量变化如图所示,则下列说法正确的是( )
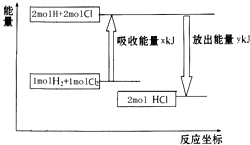

| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
2.有机物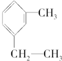 用系统命名法命名为( )
用系统命名法命名为( )
 用系统命名法命名为( )
用系统命名法命名为( )| A. | 间甲乙苯 | B. | 1,3-甲乙苯 | ||
| C. | 1-甲基-3-乙基苯 | D. | 1-甲基--5-乙基苯 |
19.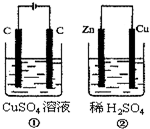 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )| A. | 右边电极上生成物质的物质的量:①=② | |
| B. | 相同状态下电极上产生气体的体积:①=② | |
| C. | 溶液的pH变化:①减小,②增大 | |
| D. | 电极反应式①中阴极Cu2++2e-═Cu:②中负极:Zn-2e-═Zn2+ |
20.化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数.下列关于这些常数的说法中,正确的( )
| A. | 化学平衡常数的大小与温度、浓度、压强、催化剂有关 | |
| B. | CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与 Kb(NH3•H2O)近似相等 | |
| C. | Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(s)+I-═AgI(s)+Cl-不能够发生 | |
| D. | Ka(HCN)<Ka(CH3COOH)说明相同浓度时,氢氰酸的酸性比醋酸强 |