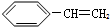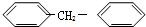题目内容
9.写出下列反应中类型①
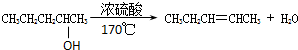 消去反应
消去反应②
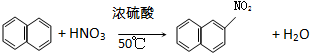 取代反应
取代反应③
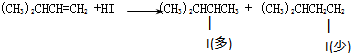 加成反应
加成反应④
 取代反应
取代反应( 式中的R为 CH3(CH2)15CH2-)
分析 取代反应是有机物中的氢原子或原子团被其他原子或原子团代替的反应;
有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
消去反应是有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H₂O、HX等),而生成含不饱和键的化合物的化学反应;
根据有机物中断键和成键方式判断反应类型.
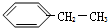
解答 解:①该有机物在浓硫酸作催化剂、加热条件下失去一个水分子生成乙烯,该反应属于消去反应;
②萘分子中的H原子被硝基取代生成 ,该反应的反应类型是取代反应;
,该反应的反应类型是取代反应;
③烯烃中的碳碳双键断裂,含有半键的C原子分别结合一个H原子、一个I原子,生成新的有机物,反应类型是加成反应;
④该有机物中的酯基断裂被羟基、H原子取代生成羧酸和丙三醇,反应类型是取代反应,
故答案为:消去反应;取代反应;加成反应;取代反应.
点评 本题考查有机化学反应类型判断,侧重考查基本概念,明确断键和成键方式是解本题关键,注意各个有机反应类型区别,注意:水解反应、酯化反应都属于取代反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 常温常压下,2.3gNa+中含有的电子数为NA | |
| C. | 标准状况下,11.2L臭氧含有的氧原子数为NA | |
| D. | 0.1 mol•L-1Na2CO3溶液中含有的钠离子数为0.2NA |
17.下列各原子或离子的电子排布式错误的是( )
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
4.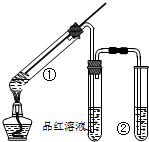 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应的产物,下列有关说法不正确的是( )| A. | 浓硫酸既表现了强氧化性,又表现了酸性 | |
| B. | 品红溶液的作用是吸收SO2,防止空气污染 | |
| C. | 该实验体现环境保护和节约化学试剂的理念 | |
| D. | 装置②中盛放的试剂可能NaOH是溶液 |
1.以下实验方法肯定错误的是( )
| A. | 判断H2O2分解速率的大小,可以通过测定单位时间内H2O2分解放出的O2的体积 | |
| B. | 制摩尔盐时用酒精洗涤产品 | |
| C. | 用米汤直接检验食用盐中是否含有碘元素 | |
| D. | 以硝酸钠和氯化钾为原料可以制备硝酸钾 |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
19.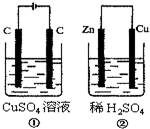 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )| A. | 右边电极上生成物质的物质的量:①=② | |
| B. | 相同状态下电极上产生气体的体积:①=② | |
| C. | 溶液的pH变化:①减小,②增大 | |
| D. | 电极反应式①中阴极Cu2++2e-═Cu:②中负极:Zn-2e-═Zn2+ |