题目内容
7.下列关于同温同压下,同质量气体H2、D2、T2的叙述中,正确的是( )①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
分析 ①同温同压下,密度之比等于摩尔质量之比;
②根据n=$\frac{m}{M}$知道质量相同时物质的量之比与摩尔质量成反比,H2、D2、T2分子都含有2个质子,据此判断;
③结合H2、D2、T2分子含有中子数判断;
④同温同压下,体积之比等于物质的量之比.
解答 解:①同温同压下,密度之比等于摩尔质量之比,故H2、D2、T2三种气体的摩尔质量之比=2g/L:4g/mol:6g/mol=1:2:3,故①正确;
②根据n=$\frac{m}{M}$可知,相同质量时,物质的量之比与摩尔质量成反比,等质量H2、D2、T2三种气体的物质的量之比=6g/mol:4g/mol:2g/mol=6:3:2,H2、D2、T2分子都含有2个质子,故质子数之比=气体物质的量之比=6:3:2,故②正确;
③等质量H2、D2、T2三种气体的物质的量之比为6:3:2,H2、D2、T2分子分别含有中子数为0、2、4,故中子数之比=0:6:8=0:3:4,故③正确;
④等质量H2、D2、T2三种气体的物质的量之比为6:3:2,同温同压下,体积之比等于物质的量之比=6:3:2,故④正确,
故选A.
点评 本题考查物质的量相关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列各原子或离子的电子排布式错误的是( )
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
18.现有部分短周期元素的性质或原子结构如下表:
(1)元素T位于元素周期表的第三周期第ⅥA族.写出T2-的原子结构示意图 .
.
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数比K层电子数多4个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 .
.(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式NH4++H2O?NH3.H2O+H+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填化学式).
15.化学反应H2+Cl2═2HCl的能量变化如图所示,则下列说法正确的是( )
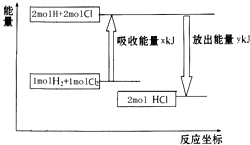

| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
2.有机物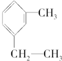 用系统命名法命名为( )
用系统命名法命名为( )
 用系统命名法命名为( )
用系统命名法命名为( )| A. | 间甲乙苯 | B. | 1,3-甲乙苯 | ||
| C. | 1-甲基-3-乙基苯 | D. | 1-甲基--5-乙基苯 |
12.R、X、Y、Z、Q、W是六种原子序数依次增大的短周期元素,其相关信息如下表:
(1)Y的元素名称氮,它在元素周期表中位置是第2周期,第VA族;
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是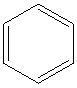 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
(2)元素非金属性X比W弱(填“强”或“弱”); X和W的最高价氧化物对应的水化物中,酸性较强的是HClO4(写化学式)
(3)R与X形成的化合物中,分子中R、X原子个数比为1:1,且分子中只有一种环境的R原子,常温下呈液态,该物质的结构简式是
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
19.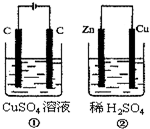 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
 如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )
如图所示的两个实验装置中,溶液的体积均 为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是( )| A. | 右边电极上生成物质的物质的量:①=② | |
| B. | 相同状态下电极上产生气体的体积:①=② | |
| C. | 溶液的pH变化:①减小,②增大 | |
| D. | 电极反应式①中阴极Cu2++2e-═Cu:②中负极:Zn-2e-═Zn2+ |
16.下列有关纤维素的叙述正确的是( )
| A. | 纤维素在稀硫酸、加热的条件下水解 | |
| B. | 棉制品吸湿性好和分子中具有-OH有关 | |
| C. | 纤维指的就是纤维素 | |
| D. | 纤维素因分子结构中含-OH,可和浓HNO3发生硝化反应 |
17.下列关于化学反应速率及化学反应限度的说法正确的是( )
| A. | 当一个化学反应达到一定反应限度时,该反应就停止了 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”表示的意思是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的限度 | |
| D. | 对于不同的化学反应而言,化学反应速率大的不一定反应就快 |