题目内容
13.下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第5项应为( )| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
分析 由表格中各烷烃的分子式可知:奇数项的C原子个数为前一奇数项中烷烃的C和H原子个数之和,偶数项亦是如此,据此判断第5项含有的碳原子数,然后利用烷烃通式判断其分子式.
解答 解:根据表中各烷烃的分子式可知:各奇数项的C原子个数为前一奇数项中烷烃的C和H原子个数之和,则第5项的C原子数为:5+12=17,所以第5项的分子式为:C17H36,
故选B.
点评 本题考查有机化合物中碳的成键特征,题目难度中等,侧重考查学生查找规律的能力及逻辑推理能力,解题时注意结合题干信息查找规律.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | 淀粉、纤维素水解的最终产物均为葡萄糖 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 | |
| C. | 葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应 | |
| D. | 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
8.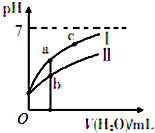 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
(1)图象中,曲线Ⅰ表示的酸是CH3COOH(填化学式);起始时,c(CH3COOH)<c(HClO)
(填“>”、“<”、“=”).
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=$\frac{1}{3}$×10-6mol•L-1.
(4)向NaClO溶液中通入少量CO2的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
(填“>”、“<”、“=”).
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=$\frac{1}{3}$×10-6mol•L-1.
(4)向NaClO溶液中通入少量CO2的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
5.下列关于元素周期表与化学键的知识叙述错误的是( )
| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
2.已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是( )
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
3.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)上述元素中,化学性质最不活泼的是Ar(填元素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是 .
.
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是
 .
.(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.