题目内容
5.下列关于元素周期表与化学键的知识叙述错误的是( )| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
分析 A、过渡元素都是金属元素,金属元素能用于制备催化剂及耐高温和耐腐蚀的物质;
B、化学键包含离子键和共价键;
C、常温常压下,相同体积的气体物质的量相同;
D、F2、Cl2、Br2、I2共价键逐渐减弱,相对分子量增大,熔点依次升高.
解答 解:A、过渡元素都是金属元素,金属元素能用于制备催化剂及耐高温和耐腐蚀的物质,故A正确;
B、化学键包含离子键和共价键,化学键可以使离子结合(离子键),也可以使原子结合(共价键),故B正确;
C、常温常压下,相同体积的气体物质的量相同,所以分子数相同,故C正确;
D、F2、Cl2、Br2、I2共价键逐渐减弱,相对分子量增大,熔点依次升高,故D错误;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及化合物中的化学键判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.与主族元素在元素周期表中所处的位置有关的是( )
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
19.下列离子方程式书写正确的是( )
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
13.下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第5项应为( )
| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
20.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 1mol羟基与17g NH3所含电子数都为10NA | |
| B. | 1molCl2溶于水的过程中有NA个电子转移 | |
| C. | 1molC(金刚石)中σ 键的数目为2NA | |
| D. | 适量铜粉溶解于1L 0.5 mol/L稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
17.在如图所示的原电池中,下列说法不正确的是( )
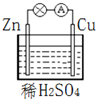

| A. | 该装置能将电能转化为化学能 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
15.下列叙述中正确的是( )
| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
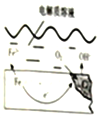 如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈
如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈