题目内容
8.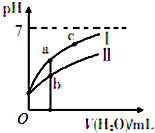 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
(填“>”、“<”、“=”).
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=$\frac{1}{3}$×10-6mol•L-1.
(4)向NaClO溶液中通入少量CO2的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
分析 (1)pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸中离子浓度越大则酸溶液的导电性越强;
(2)酸溶液中氢离子浓度越小,酸抑制水电离程度越小;
(3)NaClO的水解平衡常数Kh=$\frac{[HClO]•[O{H}^{-}]}{[Cl{O}^{-}]}$=$\frac{{K}_{W}}{{K}_{a}(HClO)}$;
(4)酸性强弱H2CO3>HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸.
解答 解:(1)据电离平衡常数可知,醋酸的酸性比次氯酸强,pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,所以曲线Ⅰ表示的酸是CH3COOH,起始氢离子浓度相同,所以次氯酸浓度大于醋酸,故答案为:CH3COOH;<;
(2)酸溶液中氢离子浓度越小,酸抑制水电离程度越小,a、b、c三点溶液中C(H+)大小顺序是b>a>c,所以水电离程度c>a>b,故答案为:c>a>b;
(3)NaClO的水解平衡常数Kh=$\frac{[HClO]•[O{H}^{-}]}{[Cl{O}^{-}]}$=$\frac{{K}_{W}}{{K}_{a}(HClO)}$=$\frac{1.0×1{0}^{-14}}{3.0×1{0}^{-8}}$=$\frac{1}{3}$×10-6 mol•L-1,故答案为:$\frac{1}{3}$×10-6 mol•L-1;
(4)酸性强弱H2CO3>HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故答案为:ClO-+CO2+H2O═HClO+HCO3-.
点评 本题考查离子浓度大小的比较,侧重于弱电解质的电离的考查,为高频考点,根据酸的电离常数与酸根离子水解程度、酸的酸性强弱等知识点来分析解答.

 单元期中期末卷系列答案
单元期中期末卷系列答案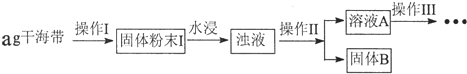
(1)操作Ⅰ为灼烧,则灼烧时应该用坩埚(仪器名称)盛装海带,操作Ⅱ为过滤;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是加快含碘物质在水中的溶解,以使灰烬中的含碘物质尽可能多的进入溶液.
(3)操作Ⅲ,是同学们对溶液A中碘元素的存在形式进行的探究实验.
[推测]:①以IO3-形式存在; ②以I-形式存在
[查阅资料]:IO3-具有较强的氧化性;I2+2S2O32-═2I-+S4O62-将上述溶液稀释配制成200mL溶液,请完成下列实验探究.
限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管I中加入FeCl2溶液,后加入2滴KSCN溶液并振荡; | 无现象 | 证明不是以IO3-形式存在 |
| ③ | 往试管II中加入3%H2O2溶液并振荡 | 溶液变蓝 | 证明以I-形式存在 |
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;
②在溶液B加入2滴淀粉溶液,用0.01mol/L Na2S2O3溶液,滴定至终点,终点现象为溶液蓝色刚好褪去,30s内不恢复蓝色,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,海带中碘元素的百分含量为$\frac{1.27v}{a}%$.假设操作Ⅰ、Ⅱ中碘不损失,原子量I-127)
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
| A. | 1mol羟基与17g NH3所含电子数都为10NA | |
| B. | 1molCl2溶于水的过程中有NA个电子转移 | |
| C. | 1molC(金刚石)中σ 键的数目为2NA | |
| D. | 适量铜粉溶解于1L 0.5 mol/L稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
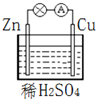
| A. | 该装置能将电能转化为化学能 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
| A. | 碱性锌锰电池 | B. | 手机用锂电池 | C. | 汽车用铅蓄电池 | D. | 玩具用镍氢电池 |
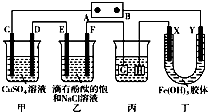 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题: