题目内容
1.写出下列反应的热化学方程式.(1)在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,写出H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$ O2(g)=H2O(l)△H=-285.8kJ/mol
(2)1.00L 1.00mol/L硫酸与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其
中和热的热化学方程式为$\frac{1}{2}$ H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92 kJ/mol
(4)已知:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ/mol
请写出CO还原FeO的热化学方程式:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11 kJ/mol
(5)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ/mol、285.8kJ/mol和393.5kJ/mol,则反应C(s)+2H2(g)=CH4(g)的反应热△H=-74.8kJ/mol.
(6)已知:2H2(g)+O2(g)═2H2O(g)△H1
2H2(g)+O2(g)═2H2O(l)△H2
2CO(g)+O2(g)═2CO2(g)△H3
①液态水转化气态水的热化学方程式为H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$kJ/mol
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是$\frac{△{H}_{1}}{△{H}_{3}}$.
分析 (1)在101kPa时,一定量H2在O2中完全燃烧生成2.00mol液态H2O.放出571.6kJ的热量,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热,以此书写中和热的热化学方程式;
(3)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(4)盖斯定律盖斯定律盖斯定律的含义是反应热是状态函数,与反应途径无关,根据目标方程式将已知的热化学方程式运用叠加的方法,得到目标方程式,反应热作相应的运算;
(5)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,根据盖斯定律计算得到所需热化学方程式;
(6)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②依据热化学方程式列式计算得到.
解答 解:(1)一定量H2在O2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量,所以1mol氢气完全燃烧放出热量285.8KJ,氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(l)△H=-285.8kJ/mol;
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:$\frac{1}{2}$ H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ/mol;
(4):①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11 kJ/mol;
(5)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol;
根据盖斯定律,由①+②×2-③得,C(s)+2H2(g)=CH4(g),△H=[(-393.5kJ/mol)+(-285.8kJ/mol)×2]-(-890.3kJ/mol)=-74.8kJ/mol,
故答案为:-74.8kJ/mol;
(6)①2H2(g)+O2(g)=2H2O(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
两式相减除以2得到:H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$kJ/mol;
故答案为:H2O(l)═H2O(g)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$kJ/mol;
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,设氢气和一氧化碳物质的量分别为x,y
2H2(g)+O2(g)=2H2O(g)△H1
2△H1
x $\frac{X△{H}_{1}}{2}$
2CO(g)+O2(g)=2CO2(g)△H3
2△H3
y $\frac{y△{H}_{3}}{2}$
$\frac{X△{H}_{1}}{2}$=$\frac{y△{H}_{3}}{2}$
所需CO和H2的体积比等于物质的量之比=$\frac{△{H}_{1}}{△{H}_{3}}$,
故答案为:$\frac{△{H}_{1}}{△{H}_{3}}$.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 存在于氧气和三氧化硫中 | B. | 只存在于三氧化硫中 | ||
| C. | 三种物质中都有 | D. | 无法判断 |
| A. | 31g白磷中含有的共价键数目为1.5NA | |
| B. | 0.1L3.0mol•L-1的NH4N03溶液中含有的NH4+的数目为0.3NA | |
| C. | 标准状况下,22.4L己烷中含共价键数目为19NA | |
| D. | 常温常压下,lmolCl2与足量的水充分反应,转移的电子数目为NA |
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 碱性溶液中:K+、Mg2+、S2-、ClO- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 在AlCl3溶液中:K+、Na+、HCO3-、SO42- |
| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
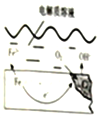 如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈
如图是钢铁在潮湿空气能发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈 ,写出水分子的电子式
,写出水分子的电子式 .
.