题目内容
3.表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是
 .
.(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,
(1)稀有气体化学性质最不活泼;
(2)非金属性越强,最高价氧化物对应水化物酸性越强,酸性最强的为高氯酸;
(3)②的氢化物为NH3,氨气为非电解质;元素⑦与④形成化合物为氯化钠,氯化钠为离子化合物,电子式中阴阳离子需要标出所带电荷;
(4)元素⑤的最高价氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(5)元素④的某氧化物可作供氧剂,该氧化物为过氧化钠,过氧化钠中含有离子键和共价键;过氧化钠与二氧化碳反应生成碳酸钠和氧气.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar,
(1)稀有气体Ar的化学性质最不活泼,则化学性质最不活泼的为Ar,
故答案为:Ar;
(2)以上元素中,最高价氧化物对应水化物的酸性最强的为高氯酸,化学式为HClO4,
故答案为:HClO4;
(3)②的氢化物为NH3,氨气为非电解质;元素⑦与④形成化合物为NaCl,氯化钠为离子化合物,其电子式为: ,
,
故答案为:非电解质; ;
;
(4)⑤为Al元素,其最高价氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-,
故答案为:Al2O3+2OH-=H2O+2AlO2-;
(5)元素④的某氧化物可作供氧剂,该氧化物为过氧化钠,过氧化钠中所含的化学键类型有离子键和共价键;过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:离子键、共价键;2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,熟练掌握元素周期表结构、元素周期律内容为解答关键,注意掌握常见化学用语的书写原则,能够正确书写常见反应的离子方程式、化学方程式.

 中考解读考点精练系列答案
中考解读考点精练系列答案| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
| A. | 碱性锌锰电池 | B. | 手机用锂电池 | C. | 汽车用铅蓄电池 | D. | 玩具用镍氢电池 |
| A. | 18 g H2O中所含的电子总数为10NA个 | |
| B. | 1 L 1 mol•L-1的盐酸中含有的HCl分子数为NA个 | |
| C. | 1 mol I2晶体完全升华后所得气体的体积约为22.4 L | |
| D. | 常温下78 g Na2O2中含有O2-的数目为2NA个 |
| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
| A. | 盐酸、氨气和碳酸钠都是电解质 | |
| B. | 常温常压下,22.4L CO2气体的物质的量大于1mol | |
| C. | 2.4克石墨和C60的混合物所含碳原子数约为0.2×6.02×1023 | |
| D. | 氢氧化铁胶体较稳定,是因为该胶体带有正电荷 |
| A. |  用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. |  图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 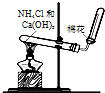 图装置可用于实验室制取氨气 |

 ,写出水分子的电子式
,写出水分子的电子式 .
.