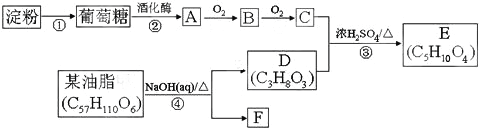
题目内容
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
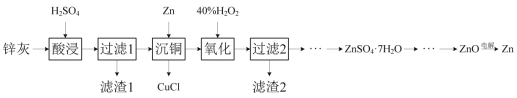
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和___。
(2)酸浸时,硫酸浓度不能过高,原因是___。
(3)写出“沉铜”时的离子方程式___。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___。
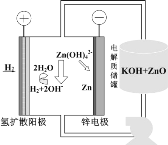
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2SZnS(s)+2H+。处理后的废水中部分微粒浓度为:
微粒 | H2S | CH3COOH | CH3COO- |
浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
【答案】PbSO4 产生SO2气体,污染环境或无法反应(速率慢)等 Zn+2Cu2++2Cl-=2CuCl↓+Zn2+ 促使Fe(OH)3胶体聚沉,有利于过滤分离 2 H2+Zn(OH)![]()
![]() 2H2O+Zn+2OH- 5 1×10-11mol·L-1
2H2O+Zn+2OH- 5 1×10-11mol·L-1
【解析】
锌灰(主要成分是ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO等)用硫酸酸浸,其中PbO转化成PbSO4沉淀,SiO2不溶于酸或水,则过滤得到的滤渣1主要为PbSO4、SiO2;滤液含有ZnSO4、FeSO4、CuSO4和H2SO4,向滤液中加入Zn粉,将Cu2+还原利用生成CuCl沉淀达到沉铜的目的,继续向溶液中加入双氧水将Fe2+氧化成Fe3+,再加入ZnO调节溶液pH,将Fe3+转化成氢氧化铁沉淀并过滤除去,将滤液蒸发、浓缩并冷却结晶,过滤得到ZnSO47H2O,滤液加入氢氧化钠溶液可生成氢氧化锌,加热分解生成氧化锌,最后电解生成Zn,以此解答该题。
(1)由分析可知,滤渣1的主要成分为SiO2和PbSO4;
(2)浓硫酸有强氧化性,酸浸时,如使用硫酸浓度过高,反应速率会很慢,在溶解时会氧化FeO生成Fe3+,同时生成SO2,污染环境,发生反应的化学方程式2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O;
(3)“沉铜”时加入Zn粉,将Cu2+还原利用生成CuCl沉淀,发生反应的离子方程式为Zn+2Cu2++2Cl-=2CuCl↓+Zn2+;
(4)在pH为5.6的条件下氧化后,生成的Fe3+水解生成氢氧化铁胶体,继续加入聚丙烯酰胺絮凝剂并加热搅拌,可促使Fe(OH)3胶体聚沉,有利于过滤分离;
(5)储罐内ZnO溶解后形成Zn(OH)![]() 离子,发生的离子反应2OH-+ZnO+H2O=Zn(OH)
离子,发生的离子反应2OH-+ZnO+H2O=Zn(OH)![]() ,则每溶解1molZnO,需消耗2molKOH;电解池阳极上的H2在碱性条件下失电子氧化生成H2O,电极反应为H2-2e-+2OH-=2H2O,阴极上Zn(OH)
,则每溶解1molZnO,需消耗2molKOH;电解池阳极上的H2在碱性条件下失电子氧化生成H2O,电极反应为H2-2e-+2OH-=2H2O,阴极上Zn(OH)![]() 离子得电子还原生成Zn,电极反应式为Zn(OH)
离子得电子还原生成Zn,电极反应式为Zn(OH)![]() +2e-=Zn+4OH-,则电解池中的总反应离子方程式为H2+Zn(OH)42-
+2e-=Zn+4OH-,则电解池中的总反应离子方程式为H2+Zn(OH)42-![]() 2H2O+Zn+2OH-;
2H2O+Zn+2OH-;
(6)已知Ka(CH3COOH)= ![]() ,则c(H+)=1×10-5mol/L,此时溶液pH=5;Ka1(H2S)×Ka2(H2S) =
,则c(H+)=1×10-5mol/L,此时溶液pH=5;Ka1(H2S)×Ka2(H2S) =![]() ×
×![]() =
=![]() =1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,则c(S2-)=1.0×10-12 mol/Lspan>,此时Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),则c(Zn2+)=1×10-11mol·L-1。
=1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,则c(S2-)=1.0×10-12 mol/Lspan>,此时Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),则c(Zn2+)=1×10-11mol·L-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案