题目内容
【题目】I.按要求填空:
(1)浓度均为0.1mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵,四种溶液中由水电离出的H+浓度由大到小的顺序是________(填序号)。
(2)现将足量的固体AgCl分别放入下列物质中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸馏水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列顺序是______(填序号)。
(3)Na2CO3溶液中离子浓度由大到小的顺序为________。
(4)CuSO4溶液中含有Fe2(SO4)3杂质,除杂试剂为________。
(5)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________。
(6)将25℃下pH=12的Ba(OH)2溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=________。(溶液体积变化忽略不计)。
II.常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________。
(2)Na2A的水溶液呈________性,原因是(用离子方程式表示):________。
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________。
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为_______mol·L-1。(忽略A2-的水解)
【答案】④>②>③>① ④>②>③>①>⑤ c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) CuO、Cu(OH)2、Cu2(OH)2CO3等 Al3++3HCO3-=Al(OH)3↓+3CO2↑ 10:1 H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2- 碱 A2-+H2O
H++A2- 碱 A2-+H2O![]() HA-+OH-、HA-+H2O
HA-+OH-、HA-+H2O![]() H2A+OH- c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 5.4×10-10
H2A+OH- c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 5.4×10-10
【解析】
I.(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)AgCl饱和溶液中存在AgCl(aq)![]() Ag+(aq)+Cl-(aq),根据AgCl的沉淀溶解平衡分析,加入Cl-平衡逆移,溶液中c(Ag+)减小,加入Ag+,则c(Ag+)增大,等浓度的Cl-、Ag+对AgCl的沉淀溶解平衡移动的影响相同;
Ag+(aq)+Cl-(aq),根据AgCl的沉淀溶解平衡分析,加入Cl-平衡逆移,溶液中c(Ag+)减小,加入Ag+,则c(Ag+)增大,等浓度的Cl-、Ag+对AgCl的沉淀溶解平衡移动的影响相同;
(3)根据盐电离产生的离子关系及盐的水解规律判断Na2CO3溶液中离子浓度大小关系;
(4)利用Fe(OH)3、Cu(OH)2形成沉淀的溶液的pH大小除杂;
(5)根据两种盐水解相互促进产生的物质分析;
(6)酸碱混合溶液为中性,说明溶液中氢离子与氢氧根离子的物质的量相等,利用溶液的pH与c(H+)及Kw计算;
II.(1)某水溶液M中存在的分子有H2O、H2A,则H2A为弱酸,根据弱酸分步电离书写电离方程式;
(2)根据盐的水解规律判断分析;
(3)根据多元弱酸的盐水解以第一步水解为主,判断溶液中离子浓度大小;
(4)根据二者物质的量关系可知溶液中A2-过量,先计算反应后c(A2-),然后利用溶度积常数计算溶液中c(Ba2+)。
(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度c(H+)由大到小的顺序是④②③①;
(2)先根据加入c(Cl-)大小比较,加入c(Cl-)越小,则c(Ag+)越大。
①c(Cl-)=0.04mol/L,②c(Cl-)=0.01mol/L,③c(Cl-)=0.03mol/L,④没有加入Cl-,⑤c(Ag+)=0.05mol/L,所以c(Ag+)由大到小排列顺序是④>②>③>①,而⑤加入的是银离子,c(Ag+)=0.05mol/L,同样是抑制AgCl溶解,可视为加入Cl-的浓度c(Ag+)=0.05mol/L,因此AgCl的溶解度由大到小的排列顺序是:④>②>③>①>⑤;
(3) Na2CO3电离方程式为:Na2CO3=2Na++CO32-,微粒处于同一溶液,溶液的体积相等,则c(Na+)>c(CO32-);CO32-在溶液中发生水解作用,CO32-+H2O![]() HCO3-+OH-,水解产生的HCO3-会进一步发生水解产生H2CO3和OH-,所以溶液中c(OH-)>c(HCO3-),溶液中还存在水的及其微弱的电离作用产生H+和OH-,则c(HCO3-)>c(H+),促进水的电离平衡正向移动,最终达到平衡时,溶液中c(OH-)>c(H+):故该溶液中离子浓度关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
HCO3-+OH-,水解产生的HCO3-会进一步发生水解产生H2CO3和OH-,所以溶液中c(OH-)>c(HCO3-),溶液中还存在水的及其微弱的电离作用产生H+和OH-,则c(HCO3-)>c(H+),促进水的电离平衡正向移动,最终达到平衡时,溶液中c(OH-)>c(H+):故该溶液中离子浓度关系为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(4)CuSO4溶液中含有Fe2(SO4)3杂质,可根据Fe2(SO4)3形成Fe(OH)3沉淀需要的溶液的pH较小,而Cu(OH)2形成沉淀需要的溶液的pH较大的性质,向混合物中加入CuO或Cu(OH)2、Cu2(OH)2CO3等,调整溶液的介于形成Fe(OH)3沉淀的pH和形成Cu(OH)2的pH之间,杂质Fe3+形成Fe(OH)3,然后过滤,得到的滤液就是纯净的CuSO4溶液;
(5)硫酸铝电离产生的铝离子与碳酸氢钠电离产生的碳酸氢根离子混合发生双水解生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,Al(OH)3覆盖在着火物质上,隔绝空气;水气化降低温度,CO2气体逸出也使可燃物与空气隔绝,从而起到灭火作用;
(6)将25℃下pH=12的Ba(OH)2溶液c(OH-)=0.01mol/L,pH=1的HCl溶液c(H+)=0.1mol/L,将aLBa(OH)2溶液与b LHCl混合,若所得混合液为中性,则n(H+)=n(OH-),aL×0.01mol/L=bL×0.1mol/L,所以a:b=0.1:0.01=10:1。
II.(1)某M水溶液中存在的分子有H2O、H2A,则H2A为二元弱酸,由于多元弱酸分步电离,所以其电离方程式为:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2- ;
H++A2- ;
(2)Na2A是强碱弱酸盐,在其水溶液中,A2-水解消耗水电离产生的H+,使水的电离平衡正向移动,最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性,用离子方程式表示为:A2-+H2O![]() HA-+OH-、HA-+H2O
HA-+OH-、HA-+H2O![]() H2A+OH-;
H2A+OH-;
(3)若溶液M由2mol/LH2A溶液与2mol/LNaOH溶液等体积混合而得,则二者混合恰好反应产生NaHA,在溶液中NaHA电离产生Na+、HA-,HA-是弱酸的酸式酸根离子,既存在电离作用产生H+、A2-,也存在水解作用产生H2A和OH-。电离或水解都消耗HA-,所以溶液中c(Na+)>c(HA-);若所得溶液M的pH<7,说明HA-的电离程度大于其水解程度,c(H+)>c(OH-),溶液中的H+除HA-的电离作用外,还有H2O电离产生,所以c(H+)>c(A2-);水的电离程度比盐电离产生的离子HA-小很多,则c(A2-)>c(OH-),故溶液中离子浓度由大到小顺序为c(Na+)>c(HA-)> c(H+)>c(A2-)>c(OH-);
(4)往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,由于发生反应A2-+Ba2+=BaA↓二者反应按1:1关系进行,所以反应后A2-过量,剩余溶液中含有的A2-的浓度c(A2-)≈![]() mol/L,根据溶度积常数得c(Ba2+)=
mol/L,根据溶度积常数得c(Ba2+)= =mol/L=5.4×10-10mol/L。
=mol/L=5.4×10-10mol/L。

【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
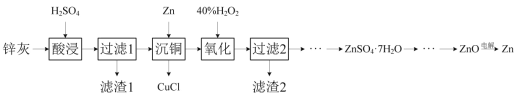
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和___。
(2)酸浸时,硫酸浓度不能过高,原因是___。
(3)写出“沉铜”时的离子方程式___。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___。
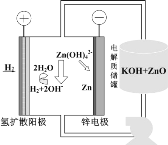
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2SZnS(s)+2H+。处理后的废水中部分微粒浓度为:
微粒 | H2S | CH3COOH | CH3COO- |
浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)