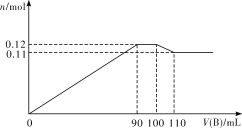
题目内容
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
【答案】A
【解析】
试题分析:n(HNO3)=0.1L×0.4mol/L=0.04mol,n(H2SO4)=0.1L×0.1moL/L=0.01moL,n(NO3-)=n(HNO3)=0.04mol,溶液中的氢离子既包括硝酸电离的又包括硫酸电离的:所以n(H+)=0.04moL+2×0.01moL=0.06mol,n(Cu)=![]() =0.03mol,
=0.03mol,
3Cu + 2NO3- + 8H+=3Cu2++2NO↑+4H2O
3mol 2mol 8mol
0.03mol 0.02mol 0.08mol
由反应关系可以看出,NO3-过量,H+不足,根据H+计算生成的铜离子,则生成的n(Cu2+)=0.06mol×![]() =0.0225mol,c(Cu2+)=
=0.0225mol,c(Cu2+)=![]() =0.225mol/L,转移的电子的物质的量为2n(Cu)=0.0225mol×2=0.045mol,所得气体在标准状况下的体积为
=0.225mol/L,转移的电子的物质的量为2n(Cu)=0.0225mol×2=0.045mol,所得气体在标准状况下的体积为![]() ×22.4L/mol=0.336L,故选A。
×22.4L/mol=0.336L,故选A。

练习册系列答案
相关题目