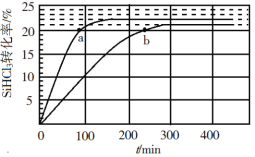
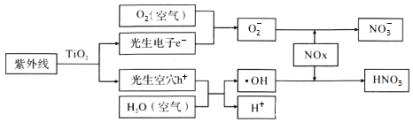
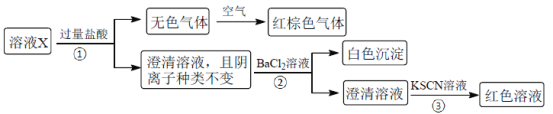
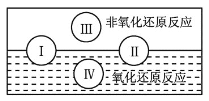
题目内容
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:
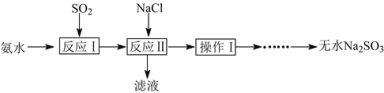
已知:①反应Ⅰ在三颈烧瓶中发生,装置如图1所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2;
③Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
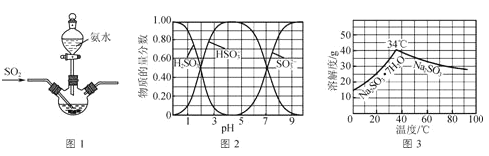
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在____左右。
(2)反应Ⅱ所得滤液的主要成分是____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液加热浓缩、____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(amol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 +KIO3=3Na2SO4+KI,消耗KIO3溶液体积为bmL。通过计算确定样品中Na2SO3的质量分数____。(写出计算过程)
【答案】9.5 NH4Cl 趁热过滤 3ab×100%
【解析】
氨水中通入二氧化硫生成亚硫酸铵,亚硫酸铵溶液中加NaCl,亚硫酸氨与氯化钠反应生成氯化铵和亚硫酸钠,加热浓缩,温度控制在80℃左右,会析出Na2SO3,过滤可得Na2SO3。
(1)图2分析可知,Na2SO3的的物质的量分数在PH=9.5左右最大,为提高Na2SO3产率,反应Ⅰ应控制pH在9.5左右,故答案为:9.5;
(2)反应Ⅱ是亚硫酸氨与氯化钠反应生成氯化铵和亚硫酸钠,反应Ⅱ所得滤液的主要成分是NH4Cl、Na2SO3,故答案为:NH4Cl;
(3)Na2SO37H2O和Na2SO3的溶解度曲线可知,温度高于34°C条件下有利于亚硫酸钠析出,操作Ⅰ得到的溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤得到晶体,故答案为:趁热过滤;
(4)消耗KIO3的物质的量为a×10-3L×bmolL-1=ab×10-3mol,发生反应3Na2SO3+KIO3=3Na2SO4+KI,可得关系式:3Na2SO3~KIO3,可知n(Na2SO3)=3n(KIO3)=3ab×10-3mol,则成品中Na2SO3的质量分数=![]() ×100%=3ab×100%,故答案为:3ab×100%。
×100%=3ab×100%,故答案为:3ab×100%。

【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
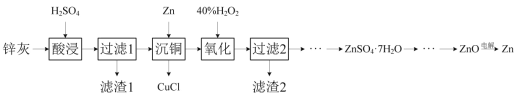
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和___。
(2)酸浸时,硫酸浓度不能过高,原因是___。
(3)写出“沉铜”时的离子方程式___。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___。
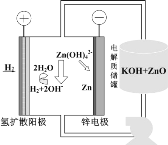
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
离子,每溶解1molZnO需消耗___molKOH。电解池中的总反应离子方程式为:___。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2SZnS(s)+2H+。处理后的废水中部分微粒浓度为:
微粒 | H2S | CH3COOH | CH3COO- |
浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)