题目内容
14.下列实验不能作为判断依据的是( )| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
分析 A、金属与水反应置换出氢气的难易程度,能判断金属性的强弱;
B、元素的金属性越强,其最高价氧化物的水化物碱性越强;
C、非金属最高价氧化物对应的水化物的酸性越强,元素的非金属性越强;
D、单质与氢气化合越容易,非金属性越强.
解答 解:A、钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁,故A正确;
B、元素的金属性越强,其最高价氧化物的水化物碱性越强,氨气和氯化镁、氯化铝溶液都反应生成氢氧化镁、氢氧化铝沉淀,不能确定氢氧化铝、氢氧化镁碱性强弱,则不能确定两种金属的金属性强弱,故B错误;
C、CO2通入硅酸钠溶液,发生强酸制取弱酸的反应,生成硅酸沉淀,可知碳酸的酸性大于硅酸,则非金属性C大于Si,故C正确;
D、卤素单质与氢气化合越容易,非金属性越强,所以能根据Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱,故D正确.
故选B.
点评 本题考查了金属性和非金属性强弱的比较方法,题目难度不大,侧重于基础知识的考查,注意有关规律的归纳整理.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 分散质直径介于1 nm-100 nm之间的分散系称为胶体 | |
| B. | Fe(OH)3难溶于水,因此不可能均匀分散在水里形成稳定的红褐色的液体 | |
| C. | 氢氧化铁胶体粒子在电泳实验中向阴极移动,是因为氢氧化铁胶体粒子带负电 | |
| D. | 胶体粒子是很多分子的集合体,因此都很不稳定,容易聚沉 |
2.下列电离方程式中,正确的是( )
| A. | Na2SO4=2Na++SO4-2 | B. | Ba(OH)2=Ba2++OH2- | ||
| C. | Fe2(SO4)3=2Fe3++3SO42- | D. | Ca(NO3)2=Ca2++2(NO3)- |
2.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
下列有关说法正确的是AD
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
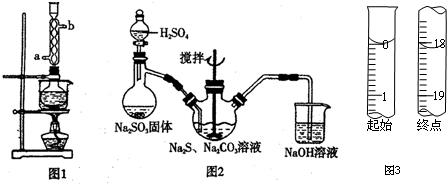
(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
Ⅰ.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
Ⅱ.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是蒸馏烧瓶,NaOH溶液的作用是吸收SO2等尾气,防止污染.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L?1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为18.10mL,产品的纯度为$\frac{0.362M}{W}$%(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果偏低(填“偏高”、“偏低”或“不变”).
9.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
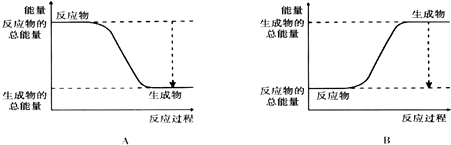
(2)如图能正确表示该反应中能量变化的是A.
(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.其中,氢气在负极发生氧化反应.电路中每转移0.2mol电子,标准状况下消耗H2的体积是2.24L.
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂
B适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
19.下列说法正确的是( )??
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为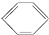 有三个双键,可与溴水发生加成反应 有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1 mL苯和1 mL水充分混合后静置,二者互溶 |
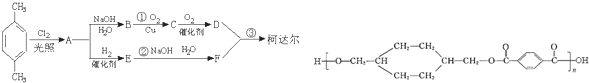
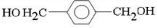 ;D
;D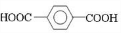 ;E
;E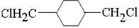
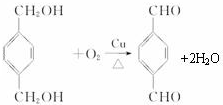 ,反应类型氧化反应
,反应类型氧化反应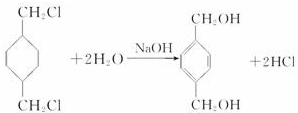 ,反应类型取代反应
,反应类型取代反应 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$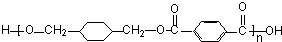 +(2n-1)H2O,反应类型缩聚反应.
+(2n-1)H2O,反应类型缩聚反应.

 ;
;