题目内容
1.下列叙述正确的是( )| A. | 分散质直径介于1 nm-100 nm之间的分散系称为胶体 | |
| B. | Fe(OH)3难溶于水,因此不可能均匀分散在水里形成稳定的红褐色的液体 | |
| C. | 氢氧化铁胶体粒子在电泳实验中向阴极移动,是因为氢氧化铁胶体粒子带负电 | |
| D. | 胶体粒子是很多分子的集合体,因此都很不稳定,容易聚沉 |
分析 A、胶体是分散质直径在1nm-100nm之间的分散系;
B、胶体能均匀分散在水里形成稳定的液体;
C、胶体粒子带电荷,但胶体呈电中性,注意二者的区别;
D、胶体具有介稳性.
解答 解:A、分散质直径介于1 nm-100nm之间的分散系称为胶体,故A正确;
B、Fe(OH)3与水一旦形成胶体,能均匀分散在水里形成稳定的红褐色的液体,故B错误;
C、胶体能发生电泳现象是由于胶体带电荷,而胶体是电中性分散系,故C错误;
D、胶体具有介稳性,有些不易聚沉,故D错误,故选A.
点评 本题主要考查的是胶体的概念以及胶体的性质,难度不大,掌握基础是关键.

练习册系列答案
相关题目
11.下列化学用语正确的是( )
| A. | 2-乙基-1,3-丁二烯分子的键线式: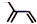 | |
| B. | 3-己炔的结构简式:CH3CH2CCCH2CH3 | |
| C. | 聚丙烯的结构简式: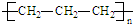 | |
| D. | 羟基的电子式: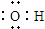 |
12.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15mol/(L•min),②v(B)=0.01mol/(L•s),③v(C)=0.40mol/(L•min),④v(D)=0.45mol/(L•min),该反应进行的快慢情况下列说法正确的是( )
| A. | ④>③>②>① | B. | ④>③>①>② | C. | ②>④=③>① | D. | ④>③=②>① |
9.下列溶液中氯离子浓度与20mL 1mol•L-1氯化铝溶液中的氯离子浓度相等的是( )
| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
13.下列有关说法错误的是( )
| A. | 物质的量浓度为1 mol/L的CuCl2溶液中,含有Cl- 个数为2NA | |
| B. | 若3.01×1023个X原子的质量为8g,则X3气体的摩尔质量是48g/mol | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm~100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 在反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O中,Cl2 既是氧化剂又是还原剂 |
10.下列电离方程式的书写错误的是( )
| A. | NaHSO4═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | HCl═H++Cl- | D. | BaSO4═Ba2++SO42- |
14.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |