题目内容
4.请写出发生下列反应的离子方程式用稀硫酸清洗铁锈(Fe2O3)6H++Fe2O3═2Fe3++3H2O
向足量澄清石灰水中通入二氧化碳Ca2++2OH-+CO2═CaCO3↓+H2O
硫酸钠溶液中加入浓的氯化钙溶液SO42-+Ca2+═CaSO4↓
向Ba(HCO3)2溶液中加入过量NaOH溶液.2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O.
分析 硫酸与氧化铁反应生成硫酸铁和水;
足量石灰水,反应生成碳酸钙;
硫酸钠溶液中加入浓的氯化钙溶液,反应生成硫酸钙沉淀和氯化钠;
向Ba(HCO3)2溶液中加入过量NaOH溶液,反应生成碳酸钡、碳酸钠和水.
解答 解:用稀硫酸清洗铁锈(Fe2O3)的离子反应为6H++Fe2O3═2Fe3++3H2O;
向足量澄清石灰水中通入二氧化碳的离子反应为Ca2++2OH-+CO2═CaCO3↓+H2O;
硫酸钠溶液中加入浓的氯化钙溶液的离子反应为SO42-+Ca2+═CaSO4↓;
向Ba(HCO3)2溶液中加入过量NaOH溶液的离子反应为2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O,
故答案为:6H++Fe2O3═2Fe3++3H2O;Ca2++2OH-+CO2═CaCO3↓+H2O;SO42-+Ca2+═CaSO4↓;2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
14.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
12.100mL 0.3mol•L-1的Na2SO4溶液和50ml 0.2mol•L-1的Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )[提示:稀溶液混合后,其体积可以相加].
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.5 mol•L-1 |
19.下列离子方程式书写正确的是( )
| A. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| B. | 碳酸氢钠溶于盐酸:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- | |
| D. | 石灰石溶于硝酸:CO32-+2H+=H2O+CO2↑ |
16.下列物质的分类组合正确的是( )
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 浓盐酸 | 纯碱 | 胆矾溶液 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
13.在Fe(NO3)2溶液中存在下列平衡:Fe2++2H2O?2Fe(OH)2+2H+,又已知Fe2+的颜色为浅绿色.现向该溶液中加入稀盐酸,则溶液的颜色为( )
| A. | 无变化 | B. | 变为无色 | C. | 变为深绿色 | D. | 变为棕黄色 |
14.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: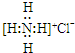 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氟化钠的电子式: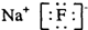 | |
| D. | 氯原子的结构示意图: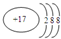 |