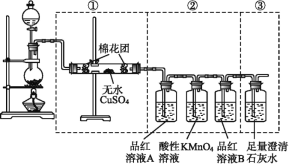
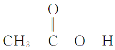题目内容
【题目】高铁酸钠(Na2FeO4)是一种高效、新型的水处理剂,在碱性条件下较稳定;在中性或弱酸性条件下转化为Fe(OH)3和O2;易被H2还原。工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备Na2FeO4并回收某些金属资源的工艺流程如图:
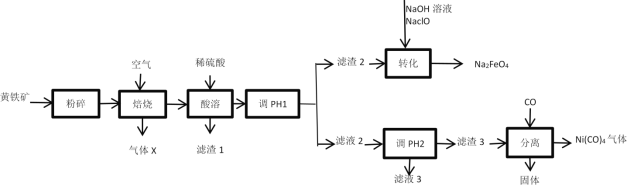
已知:
Ⅰ.“焙烧”后矿石中的金属元素均以氧化物的形式存在。
Ⅱ.溶液中离子浓度小于1×10-5mol/L时,该离子沉淀完全。
(1)“粉碎”的目的是___。
(2)气体X为__,滤渣1为__。
(3)流程中“调节pH1”的实验操作目的是___。
(4)“转化”过程中发生的主要反应的离子方程式为___。
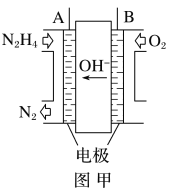
(5)采用电解法制备Na2FeO4的工作原理如图所示:
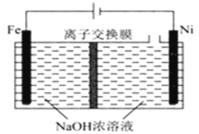
①该装置工作时,阳极的电极反应式为___。
②离子交换膜应选用___(填“阴”或“阳”)离子交换膜,原因____。
【答案】加快“焙烧”速率,使“焙烧”更充分 X为SO2 滤渣1为SiO2 “调节pH1”目的是使Fe3+转化为Fe(OH)3沉淀而Cu2+和Ni2+不沉淀 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O Fe+8OH--6e-=FeO42-+4H2O 阳 可防止FeO42-进入阴极区被H2还原
【解析】
黄铁矿粉碎,增大与空气的接触面积,可加快化学反应速率,是焙烧更加充分。充分焙烧后,得各金属的氧化物以及SiO2,矿石中的硫元素转化为SO2,加入稀硫酸酸化,SiO2不与硫酸反应过滤除去,而金属氧化物与硫酸反应得到硫酸盐,调节pH1,在滤渣2中得到Fe(OH)3,Fe(OH)3、NaClO、NaOH反应得到Na2FeO4。滤液2中有Cu2+和Ni2+;调节pH2,分离Ni和Cu;Ni(OH)2最终转化为Ni(CO)4。
(1)黄铁矿粉碎,可以增大固体的表面积,加快“焙烧速率”,使“焙烧”更充分;
(2)根据元素守恒,黄铁矿焙烧时,金属元素均转化为其氧化物,因此气体X为SO2;金属氧化物均与硫酸反应转化为可溶于水的硫酸盐,而SiO2不与硫酸反应,因此滤渣1为SiO2;
(3)根据流程图,滤渣2最终转化为Na2FeO4,因此滤渣2为Fe(OH)3,调节pH1的目的是使Fe3+转化为Fe(OH)3,与Cu2+、Ni2+分离;
(4)转化过程,Fe(OH)3、NaOH和NaClO转化为Na2FeO4,Fe的化合价从+3价升高到+6价,Cl的化合价从+1价降低到-1价,化合价升降守恒,Fe(OH)3和ClO-的系数为2:3,再根据质量守恒和电荷守恒配平,离子方程式为2Fe(OH)3+3ClO-+4OH-=FeO42-+3Cl-+5H2O;
(5)采用电解制备Na2FeO4,示意图中,Fe作阳极,失去电子,转化为FeO42-,阴极为水得到电子,生成H2和OH-;
①Fe作阳极,失去电子,转化为FeO42-,电极方程式为Fe+8OH--6e-=FeO42-+4H2O;
②Na2FeO4容易被H2还原,因此要需要防止阴极生成的H2还原FeO42-,离子交换膜应选择阳离子交换膜,可防止FeO42-进入阴极区被H2还原。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】![]() 是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | —— | —— |
(1)用![]() 还原无水
还原无水![]() 制取
制取![]() 。有关装置如图1所示:
。有关装置如图1所示:
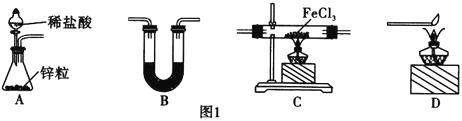
![]() 还原无水
还原无水![]() 制取
制取![]() 的化学方程式为________________________。
的化学方程式为________________________。
![]() 中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________
中盛放的试剂是________,按气流由左到右的方向,上述仪器的连接顺序为________![]() 填母,装置可多次使用
填母,装置可多次使用![]() 。
。
![]() 该制备装置的缺点为________________________________。
该制备装置的缺点为________________________________。
(2)利用反应![]() ,制取无水
,制取无水![]() 并测定
并测定![]() 的转化率。按图2装置,在三颈烧瓶中放入
的转化率。按图2装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

![]() 仪器a的作用是________________________。
仪器a的作用是________________________。
![]() 反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________
反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是________![]() 填名称
填名称![]() ,回收滤液中
,回收滤液中![]() 的操作方法是________。
的操作方法是________。
![]() 在反应开始之前先通一段时间
在反应开始之前先通一段时间![]() 的目的是________________,在反应完成后继续通一段时间
的目的是________________,在反应完成后继续通一段时间![]() 的作用是________________________________。
的作用是________________________________。
![]() 反应后将锥形瓶中溶液配成250mL,量取
反应后将锥形瓶中溶液配成250mL,量取![]() 所配溶液,用
所配溶液,用![]() 溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为
溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为![]() 、
、![]() 、
、![]() ,则氯化铁的转化率为________________。
,则氯化铁的转化率为________________。