题目内容
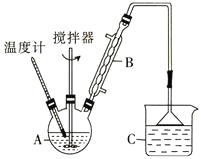
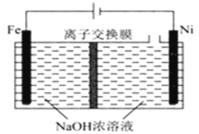
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
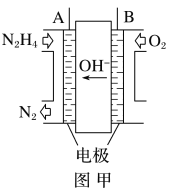
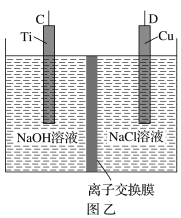
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________,
肼燃料电池中A极发生的电极反应为____________________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
【答案】B 阴 ![]()
![]() 0.05
0.05
【解析】
(1)燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极;图乙为电解池装置,电解目的为制备Cu2O,则D极作阳极接电池正极(B极),铜被氧化;阳极反应为2Cu-2e-+2OH- =Cu2O+H2O,反应消耗OH-,采用阴离子交换膜使OH-向阳极移动;
答案为B;阴;
(2)根据上述分析,阳极反应为2Cu-2e-+2OH- =Cu2O+H2O;肼燃料电池中A极肼(N2H4)失电子在碱性条件下生成氮气和水,发生的电极反应为N2H4-4e-+4OH- =N2+4H2O;
(3)根据电极反应2Cu-2e-+2OH- =Cu2O+H2O和N2H4-4e-+4OH- =N2+4 H2O可知,Cu2O与N2H4、e-的数量关系式为2Cu2O~ N2H4~4 e-,当反应生成14.4 g (0.1mol)Cu2O时,至少需要肼为0.05mol。

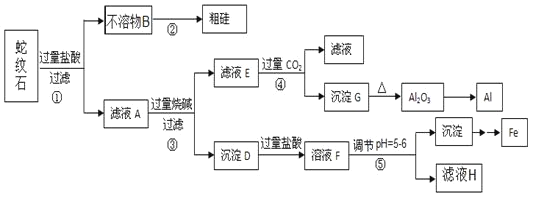
【题目】蛇纹石矿可以看作由MgO、![]() 、
、![]() 和
和![]() 组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| 1.9 | 3.2 |
| 9.4 | 11.6 |
(1)蛇纹石中所含的氧、镁、硫、铝这几种元素的简单离子的半径由小到大的顺序_____,滤液A中含有的阳离子有 _________。
(2)硅元素在周期表中的位置______,二氧化碳的电子式___________。
(3)操作②中反应的化学方程式为 ____,操作④中生成沉淀G的离子方程式为 _____。
(4)操作⑤中调节pH到![]() 时,可以用到的试剂
时,可以用到的试剂![]() 填序号
填序号![]() ____________。
____________。
a、NaOH b、氨水 c、MgO d、Mg(OH)2
(5)从滤液H制取金属Mg的流程如下:
![]()
流程中冶炼镁的方法是__________,在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________。