题目内容
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.合成氨工业用铁触媒作催化剂
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
【答案】B
【解析】
A. Na(l)+KCl(l)NaCl(l)+K(g),使K成蒸汽从反应混合物中分离出来,即减小产物的浓度,能让平衡向着正方向进行,能用勒夏特列原理解释,故A不选;
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率,但是不会引起平衡移动,不能用勒夏特列原理解释,故B选;
2NH3的反应,使用铁触媒可加快合成氨反应的速率,但是不会引起平衡移动,不能用勒夏特列原理解释,故B选;
C. 合成氨时将氨液化分离,降低生成物的浓度,平衡向正反应方向进行,提高反应物的转化率,能用勒夏特列原理解释,故C不选;
D. 水中存在如下平衡:Cl2+H2O![]() HCl+HClO,2HClO =2 HCl+O2,久置后溶液中的平衡正向移动,所以氯气的浓度减小,颜色变浅,故D不选。
HCl+HClO,2HClO =2 HCl+O2,久置后溶液中的平衡正向移动,所以氯气的浓度减小,颜色变浅,故D不选。
故选B.

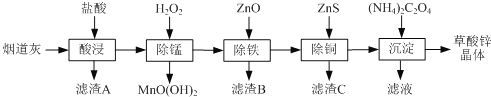
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
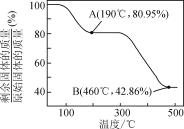
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。