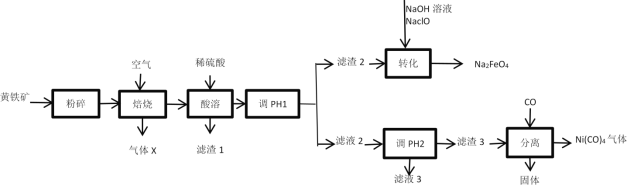
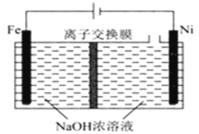
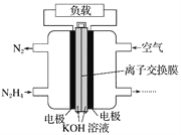
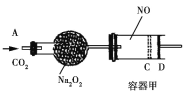
题目内容
【题目】下列说法正确的是( )
A.将两块未擦去氧化膜的铝片分别投入1mol·L-1CuSO4溶液和1mol·L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象
B.溶液酸碱性对H2O2的稳定性有较大影响,在酸性溶液中,H2O2分解较快
C.Fe3+能与硫氰化钾反应生成可溶于水的血红色配合物
D.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
【答案】C
【解析】
A. CuSO4 、CuCl2均为强酸弱碱盐,水溶液显酸性,能与两块未擦去氧化膜的铝片反应消耗氧化铝薄膜,铝片也能置换出单质铜,表面生成红色的铜,A错误;
B. 溶液酸碱性对H2O2的稳定性有较大影响,在碱性溶液中,H2O2分解较快,B错误;
C. Fe3+能与硫氰化钾反应生成可溶于水的血红色配合物,C正确;
D. 变色硅胶干燥剂含有CoCl2,CoCl2干态蓝色,CoCl2![]() 2H2O紫红色,干燥剂呈蓝色时,表示具有吸水干燥功能,D错误;
2H2O紫红色,干燥剂呈蓝色时,表示具有吸水干燥功能,D错误;
答案为C

 阅读快车系列答案
阅读快车系列答案【题目】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___。
(2)判断滴定终点的现象是___。
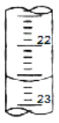
(3)如图是某次滴定时滴定管中的液面,其读数为__mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
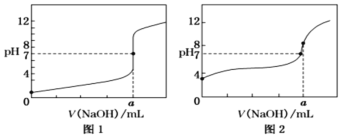
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___(填“图1”或“图2”)。
②a=___mL。