��Ŀ����
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����(����)
A.0.01 mol��L��1��ˮ�У�Cl2��Cl����ClO����������Ŀ֮�ʹ���0.01NA
B.�ڱ�״���£�11.2 L NO��11.2 L O2��Ϻ�����������Ϊ0.75NA
C.0.1 mol Cu�뺬0.2mol H2SO4��Ũ������ȫ��Ӧ����Һ��Cu2����ĿΪ0.1NA
D.2.0 g D2O�к��е�����������������ΪNA
���𰸡�D
��������
A. ��Һ�����֪��������������ȷ������A����
B. ��״���£�11.2 L NO��11.2 L O2��Ӧ����0.5 mol NO2��ʣ��0.25 mol O2����NO2����ƽ�⣺2NO2![]() N2O4�����Ϸ�Ӧ������������������Ϊ0.75NA����B����
N2O4�����Ϸ�Ӧ������������������Ϊ0.75NA����B����
C. ���ᷴӦ������Ũ�Ƚ��ͣ�Cu����ϡ���ᷴӦ������Cu2����ĿС��0.1NA����C����
D. D2O��Ħ������Ϊ20g/mol����2.0 g D2OΪ0.1mol��D2O�����к���2+8=10�����ӣ�10�����ӣ���2.0 g D2O�к��е�����������������ΪNA����D��ȷ��
��ѡD��

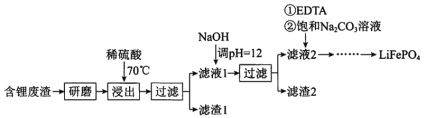
 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�����Ŀ���ڸ�����ҵ�У��̵����������������̵�ұ������ԭ��Ϊ�̿�ʯ����Ҫ�����̿�![]() ����������
����������![]() ��FeO��
��FeO��![]() ��NaCl��ʯ�ҵȣ�
��NaCl��ʯ�ҵȣ�
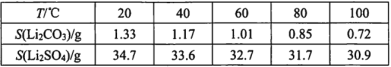
���������� |
|
|
|
|
|
��ʼ������ ��ȫ��pH |
|
|
|
|
|
��ش��������⣺
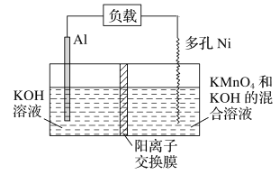
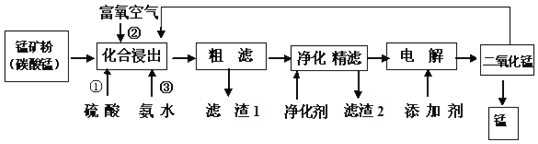
![]() �ڻ��Ͻ����У�Ϊ����߽�������߲�Ʒ���ȣ�ͨ������______
�ڻ��Ͻ����У�Ϊ����߽�������߲�Ʒ���ȣ�ͨ������______![]() ����д���ַ���
����д���ַ���![]()
![]() �ڸù�������������1�ɷֻ�ѧʽΪ______��ͨ�����뾻������Ҫ�ɷ�Ϊ
�ڸù�������������1�ɷֻ�ѧʽΪ______��ͨ�����뾻������Ҫ�ɷ�Ϊ![]() ������2��ѧʽΪ______��
������2��ѧʽΪ______��
![]() ���̺��������º���������ˮ����ҵ��DZˮԱ��Ҫ�����ľ��Ǹ����������������ø��������������������������ɱ����������õĿ�������Ĥ���뷨�Ʊ��ĸ����������÷�����ԭ����______
���̺��������º���������ˮ����ҵ��DZˮԱ��Ҫ�����ľ��Ǹ����������������ø��������������������������ɱ����������õĿ�������Ĥ���뷨�Ʊ��ĸ����������÷�����ԭ����______
![]() д��������ʱ�����ĵ缫��Ӧʽ______��
д��������ʱ�����ĵ缫��Ӧʽ______��
![]() ���ȷ������ķ������ж������̣�������Ϊ���������뻯�Ͻ���������̿�������ʣ������ӷ�Ӧ����ʽ�ǣ�______��
���ȷ������ķ������ж������̣�������Ϊ���������뻯�Ͻ���������̿�������ʣ������ӷ�Ӧ����ʽ�ǣ�______��
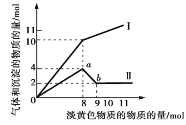
![]() �ڵ��Һ��
�ڵ��Һ��![]() ���˹������ڵ������л������Ⱦ�ͨ��Ҫ��ʱ���
���˹������ڵ������л������Ⱦ�ͨ��Ҫ��ʱ���![]() �Ĵ�С��������ʾ
�Ĵ�С��������ʾ![]() ��
��![]() ����
����![]() Ϊש��ɫ��ͨ������
Ϊש��ɫ��ͨ������![]() Ϊ�ζ�������
Ϊ�ζ�������![]() ��ָʾ�����ж����ⶨ
��ָʾ�����ж����ⶨ![]() �Ĵ�С���������ó����ζ��յ�ʱ������______����
�Ĵ�С���������ó����ζ��յ�ʱ������______����![]() ������ȫʱ
������ȫʱ![]() ��ʼ��������ʱ��Һ��
��ʼ��������ʱ��Һ��![]() ______��
______��
����Ŀ����ҵ�ϳɰ��ķ�ӦΪN2(g)��3H2(g)![]() 2NH3(g)����֪���л�ѧ���ļ��ܣ�
2NH3(g)����֪���л�ѧ���ļ��ܣ�
��ѧ�� | ����kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
����˵����ȷ����
A. �÷�ӦΪ���ȷ�ӦB. �÷�Ӧ�з�Ӧ��������������������������
C. ��Ӧ����H��92 kJ��mol��1D. ����1 mol NH3�ų�92 kJ����