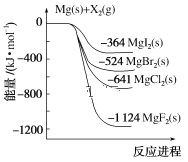
��Ŀ����
����Ŀ���ú�﮷���(��Ҫ����Ԫ�صĺ�����Li3.50% Ni 6.55% Ca 6.41% Mg 13.24%)�Ʊ�Li2CO3���������Ʊ�Li+��ص���������LiFePO4�����ֹ����������£�
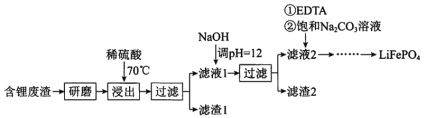
���ϣ�i. ��Һ1����Һ2�в������ӵ�Ũ��(g��L-1)��

ii. EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ��������
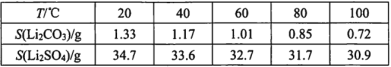
iii.ijЩ���ʵ��ܽ��(S)��
I.�Ʊ�Li2CO3��Ʒ
(1)����2����Ҫ�ɷ���____________��
(2)����Һ2���ȼ���EDTAĿ���ǣ�________���ټ��뱥��Na2CO3��Һ��90���ַ�Ӧ���������Li2CO3��Ʒ�IJ�����________��
(3)����1 kg���3.50%�ķ�����﮵Ľ�����Ϊa, Li+ת��ΪLi2CO3��ת����Ϊb,���Ʒ�к�Li2CO3��������________g��(��a,b��ʾ�軯��Ħ��������Li 7g��mol-1 Li2CO3 74 g��mol-1 )
II.����Li2CO3��Ʒ
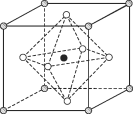
(4)��Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3�����ԭ����ͼ��ʾ�������ĵ缫��Ӧʽ��______________���ó�ʹ����________(����������������)���ӽ���Ĥ��

III.�Ʊ�LiFePO4
(5)����ؼ�Li2CO3��C�� FePO4�����·�Ӧ��������2�ֲ���������һ��Ϊ��ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡�Mg(OH)2 ��Ni(OH)2 ��Ca(OH)2 ��ȥ������ ���ȹ��� 185ab 4OH��- 4e- = O2��+2H2O �� LiCO3 + 2C + 2FePO4 = 2LiFePO4 + 3CO��
��������
�������̣�����﮷�����ĥ����70����������ϡ����������еĽ������ӣ��õ����е�Li+��Ni2+��Ca2+��Mg2+������Һ�����в���Ca2+���������������CaSO4���������ˣ�����1��Ҫ��CaSO4������Һ1�м���NaOH����pH=12����Ni2+��Ca2+��Mg2+������2��ҪΪNi��OH��2��Mg��OH��2���м�������Ca��OH��2����Һ2����Li+������Һ2���ȼ���EDTA���ټ��뱥��Na2CO3��Һ��90����ַ�Ӧ�õ����������ȹ��˵õ���ƷLi2CO3����Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3������ؼ�Li2CO3��C��FePO4�����·�Ӧ��Li2CO3+2C+2FePO4=2LiFePO4+3CO�����ݴ˷�������
��1�����ݷ�����Һ1�м���NaOH����pH=12����Ni2+��Ca2+��Mg2+��������2��ҪΪNi��OH��2��Mg��OH��2���м�������Ca��OH��2��
�ʴ�Ϊ��Ni��OH��2��Mg��OH��2��Ca��OH��2��
��2���ڵڶ��ι���֮����Һ�л��в��ָ�����û�г�ȥ��EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ�������������ȼ���EDTA���Է�ֹ�����õ���Li2CO3�л���̼��ƣ����ݱ���֪Li2CO3�����ܽ��С����90����ַ�Ӧ��ͨ�����ȹ��˷��������Li2CO3��Ʒ��
�ʴ�Ϊ����ȥ�����ӣ����ȹ��ˣ�
��3��lkg���3.50%�ķ�����﮵Ľ�����Ϊa���������n��Li+��=1000g��3.5%��a/7mol=5amol��Li+ת��ΪLi2CO3��ת����Ϊb�����Ʒ�к�Li2CO3��������5amol��1/2��b��74g/mol=185ab g��
�ʴ�Ϊ��185ab��
��5�����ݵ��ԭ��ͼ������ʧȥ���ӷ���������Ӧ���ŵ�Ϊ���������ӣ��缫��ӦΪ��4OH--4e-=2H2O+O2���������ŵ���������ӣ���������OH-����������õ�LiOH����LiOH���������ɣ�Li+����������Ϊ�����ӽ���Ĥ��
�ʴ�Ϊ��4OH--4e-=2H2O+O2��������
��6��Li2CO3��C��FePO4�����·�Ӧ������LiFePO4��һ�ֿ�ȼ�����壬����Ԫ�ط���������ΪCO����ӦΪ��LiCO3 + 2C + 2FePO4 ![]() 2LiFePO4 + 3CO����
2LiFePO4 + 3CO����
�ʴ�Ϊ��LiCO3 + 2C + 2FePO4 ![]() 2LiFePO4 + 3CO����
2LiFePO4 + 3CO����