题目内容
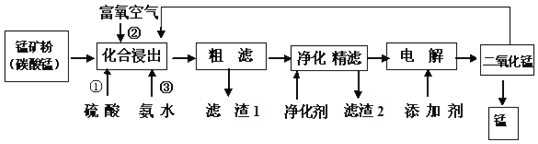
【题目】在钢铁工业中,锰的用量仅次于铁.锰的冶炼所用原料为锰矿石,主要含菱锰矿![]() ,另常含有
,另常含有![]() 、FeO、
、FeO、![]() 、NaCl和石灰等.
、NaCl和石灰等.
金属阳离子 |
|
|
|
|
|
开始至沉淀 完全的pH |
|
|
|
|
|
请回答下列问题:
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用______
在化合浸出中,为了提高浸出率提高产品纯度,通常采用______![]() 至少写两种方法
至少写两种方法![]()
![]() 在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为
在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为![]() ,滤渣2化学式为______.
,滤渣2化学式为______.
![]() 打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
![]() 写出电解操作时阳极的电极反应式______.
写出电解操作时阳极的电极反应式______.
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
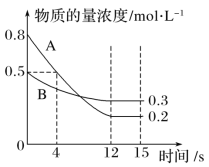
![]() 在电解液中
在电解液中![]() 不宜过大,否则在电解过程中会产生污染物,通常要定时检测
不宜过大,否则在电解过程中会产生污染物,通常要定时检测![]() 的大小,资料显示
的大小,资料显示![]() ,
,![]() ,且
,且![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小.请描述该沉淀滴定终点时的现象:______;当
的大小.请描述该沉淀滴定终点时的现象:______;当![]() 沉淀完全时
沉淀完全时![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ______.
______.
【答案】升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间 ![]() HgS 利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜
HgS 利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜 ![]()
![]() 当滴入最后一滴
当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点;
溶液时,有砖红色沉淀现象出现则达到终点; ![]()
【解析】
锰的冶炼所用原料为锰矿石,主要含菱锰矿(MnCO3),另常含有Fe2O3、FeO、HgCO32HgO、NaCl和石灰等,化合浸出过程加入硫酸、固体溶解得到溶液,通入氧气氧化亚铁离子为铁离子,加入氨水沉淀铁离子生成氢氧化铁沉淀,粗滤得到滤渣为氢氧化铁,滤液加入净化剂主要成分为(NH4)2S,精滤得到滤渣2为HgS,滤液电解得到二氧化锰,利用铝热反应生成锰单质和氧化铝,铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率。
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间等,
在化合浸出中,为了提高浸出率提高产品纯度,通常采用升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间等,
故答案为:升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间;
![]() 分析可知滤渣1为氢氧化铁,化学式为:
分析可知滤渣1为氢氧化铁,化学式为:![]() ,滤渣2为硫化汞,化学式为:HgS,
,滤渣2为硫化汞,化学式为:HgS,
故答案为:![]() ;HgS;
;HgS;
![]() 流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,
流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,
故答案为:利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜;
![]() 电解操作时阳极是锰离子失电子发生氧化反应生成二氧化锰,反应的电极反应为:
电解操作时阳极是锰离子失电子发生氧化反应生成二氧化锰,反应的电极反应为:![]()
![]() ,
,
故答案为:![]() ;
;
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,是二氧化锰氧化亚铁离子,本身被还原为锰离子,反应的离子方程式为:
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,是二氧化锰氧化亚铁离子,本身被还原为锰离子,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小,该沉淀滴定终点时的现象是当滴入最后一滴
的大小,该沉淀滴定终点时的现象是当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点,当
溶液时,有砖红色沉淀现象出现则达到终点,当![]() 沉淀完全时浓度为
沉淀完全时浓度为![]() ,此时的离子浓度
,此时的离子浓度![]() ,
,![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ,
,
故答案为:当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点;
溶液时,有砖红色沉淀现象出现则达到终点;![]() 。
。

【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。
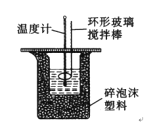
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度