题目内容
【题目】将![]() 镁铝合金加入到
镁铝合金加入到![]() 稀硝酸中,恰好完全反应后,收集到还原产物NO气体
稀硝酸中,恰好完全反应后,收集到还原产物NO气体![]() 标准状况,假设反应中还原产物只有
标准状况,假设反应中还原产物只有![]() ,向所得溶液中加入
,向所得溶液中加入![]() 溶液
溶液![]() ,沉淀部分溶解,下列有关叙述错误的是
,沉淀部分溶解,下列有关叙述错误的是
A.合金中Al的质量分数约为![]()
B.原稀硝酸的浓度为![]()
C.反应最终产生沉淀![]()
D.向产生沉淀后的混合液中滴加![]() 稀硝酸,产生的沉淀完全溶解
稀硝酸,产生的沉淀完全溶解
【答案】D
【解析】
A. 将镁、铝合金加入到稀![]() 中,两者恰好完全反应,反应中还原产物只有NO,发生反应:
中,两者恰好完全反应,反应中还原产物只有NO,发生反应:![]() 稀
稀![]() 、
、![]() 稀
稀![]() ,设Mg的物质的量为
,设Mg的物质的量为![]() ,Al的物质的量为
,Al的物质的量为![]() ,
,![]() ,根据得失电子相等:
,根据得失电子相等:![]() ,解得
,解得![]() ,
,![]() 合金中Al的质量分数为
合金中Al的质量分数为![]() ,故不选A;
,故不选A;
B. 根据反应方程式可知,硝酸的物质的量![]() ,则原稀硝酸的浓度为
,则原稀硝酸的浓度为![]() ,故不选B;
,故不选B;
C.![]() ,向反应后的溶液中加入过量NaOH溶液至沉淀完全发生反应:
,向反应后的溶液中加入过量NaOH溶液至沉淀完全发生反应:![]() 、
、![]() ,全部沉淀需NaOH为
,全部沉淀需NaOH为![]() ,过剩的氢氧化钠为
,过剩的氢氧化钠为![]() ,与0.1mol
,与0.1mol![]() 反应生成偏铝酸钠,则生成沉淀为
反应生成偏铝酸钠,则生成沉淀为![]() 和
和![]() 的
的![]() ,其质量为
,其质量为![]() ,故不选C;
,故不选C;
D.沉淀溶解需稀硝酸:氢氧化镁溶解需稀硝酸![]() ,氢氧化铝溶解需稀硝酸
,氢氧化铝溶解需稀硝酸![]() ,溶液中的
,溶液中的![]() 需稀硝酸
需稀硝酸![]() ,所需稀硝酸共
,所需稀硝酸共![]() ,体积
,体积![]() ,故选D;
,故选D;
答案:D。

练习册系列答案
相关题目
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
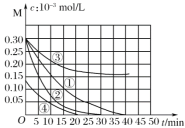
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快