题目内容
【题目】某5L溶液只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气味气体和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示。用该淡黄色物质做焰色反应,火焰呈黄色。
请回答下列问题:
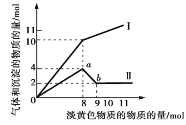
(1)生成气体的曲线是_____(填“Ⅰ”或“Ⅱ”)。
(2)ab段发生反应的离子方程式为_____________________。
(3)原溶液中所含阳离子为___。(填离子符号)阴离子浓度为_____。
【答案】I Al(OH)3+OH-=[Al(OH4)]- NH4+、Al3+、Mg2+ c(Cl-)=3.2mol/L
【解析】
淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则一定没有Fe2+和Cu2+,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,同时有气体产生速率变小,一定有NH4+、Al3+、Mg2+,则溶液中一定没有OH-,根据电荷守恒可知含有Cl-。
(1)根据分析可知答案为:I
(2)ab段为氢氧化铝沉淀和氢氧化钠反应,沉淀溶解,故答案为:Al(OH)3+OH-=[Al(OH4)]-;
(3)根据分析可知原溶液中所含阳离子为NH4+、Al3+、Mg2+;阴离子为Cl-,原溶液中加入8 mol Na2O2之后,生成气体减少,故加入8 mol Na2O2时,NH4+完全反应,由纵坐标可知:
n(Mg2+)=2 mol,n(Al3+)=4 mol-2 mol=2 mol.当n(Na2O2)=8 mol时,由2Na2O2+2H2O═4NaOH+O2↑,可知n(O2)=8 mol×1/2=4 mol,所以n(NH4+)=n(NH3)=10 mol-n(O2)=6 mol,根据电荷守恒可知n(Cl-)=2n(Mg2+)+3n(Al3+)+n(NH4+)= 2×2+2×3+6=16mol,故c(Cl-)=16mol/5L=3.2mol/L;
故答案为:NH4+、Al3+、Mg2+;c(Cl-)=3.2mol/L。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸