题目内容
12.下列各项表达中正确的是( )| A. | Na2O2的电子式为 | |
| B. | 原子最外层电子数为2的元素一定位于周期表第ⅡA族 | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为  |
分析 A、Na2O2是钠离子和过氧根离子构成的离子化合物,含有离子键和共价键;
B、原子最外层电子数为2的元素可以是第ⅡA族以及He元素、Fe元素等;
C、在氮原子中,质子数为7,但是中子数不确定;
D、氯离子原子最外层达到了8电子的稳定结构.
解答 解:A、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故A错误;
,故A错误;
B、原子最外层电子数为2的元素可以可以是第ⅡA族以及He元素(0族)、Fe元素(ⅤⅢ族)等,故B错误;
C、在氮原子中,质子数为7,但是中子数得看质量数的大小,故C正确;
D、氯离子原子最外层达到了8电子的稳定结构, 是氯原子的结构示意图,故D错误.
是氯原子的结构示意图,故D错误.
故选C.
点评 本题考查了微粒结构示意图、电子式的书写方法、元素在元素周期表中的位置等知识,注意书写电子式时,原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
相关题目
2.将CuCl2、NaCl、AlCl3、FeCl2、FeCl3、NH4Cl、AgNO3七种溶液区分开,只用一种试剂,该试剂是( )
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
3.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,该现象不能(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是过量的Cl2也可以将I-氧化为I2.
(5)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液 不能选用下列中的b(填字母编号).
a.饱和NaOH溶液
b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液
d.饱和Na2CO3溶液.

(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液 不能选用下列中的b(填字母编号).
a.饱和NaOH溶液
b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液
d.饱和Na2CO3溶液.
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: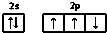 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
17.下列性质能肯定该物质为离子化合物的是( )
| A. | 第ⅠA族与第ⅦA族元素形成的化合物 | B. | 溶于水中能导电的化合物 | ||
| C. | 在熔化状态下能导电的化合物 | D. | 熔点高的化合物 |
4.下列装置或操作能达到实验目的是( )
| A. | 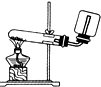 实验室制取并收集NH3 | B. | 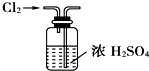 干燥Cl2 | ||
| C. | 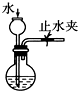 检查装置气密性 | D. |  利用排空气法收集CO2 |
1.元素周期表的一部分,针对表中的①…⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的元素是F,(填元素符号);
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为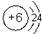 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为
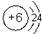 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
2.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体有沉淀产生.则通入的该气体可能是( )
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
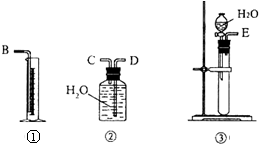 现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.
现有含CaO杂质的CaC2试样.某研究性学习小组的同学用图中的装置,设计一个实验,测定CaC2试样的纯度.