题目内容
5.将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2?2NH3,下列关于该反应的说法中正确的是( )| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
分析 A、增大压强反应速率增大,正逆反应速率都增大;
B、反应是可逆反应不能进行彻底;
C、升温,正逆反应速率都增大;
D、任何化学反应中正反应速率之比等于化学计量数之比.
解答 解:A、增大压强,活化分子浓度增大,所以反应速率增大,故A错误;
B、反应是可逆反应不能进行彻底,将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3.生成的氨气物质的量一定小于0.2mol,故B错误;
C、升温,活化分子百分数增大,反应速率增大,故C正确;
D、反应速率之比等于化学方程式计量数之比,反应过程中和化学平衡状态都符合,不能说明反应达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握原理应用是关键,题目较简单.

练习册系列答案
相关题目
16.下列物质属于苯的同系物是( )
| A. | 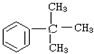 | B. |  | C. | 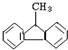 | D. | 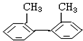 |
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: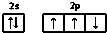 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
10.下列各组物质中,互为同位素的是( )
| A. | O2、O3 | B. | H2、D2、T2 | C. | H2O、D2O、T2O | D. | ${\;}_{1}^{1}$H ${\;}_{1}^{2}$H |
17.下列性质能肯定该物质为离子化合物的是( )
| A. | 第ⅠA族与第ⅦA族元素形成的化合物 | B. | 溶于水中能导电的化合物 | ||
| C. | 在熔化状态下能导电的化合物 | D. | 熔点高的化合物 |
14.下列各组元素性质递变规律不正确的是( )
| A. | N、O、F原子半径依次增大 | |
| B. | P、S、Cl元素最高化合价依次增高 | |
| C. | Li、Be、B三种元素的原子随着原子序数的增加最外层电子数依次增多 | |
| D. | Na、K、Rb的金属性依次增强 |
15.下列溶液可用于鉴别CO2与SO2气体的有( )
①品红溶液②氯化钙③酸性高锰酸钾④溴水⑤氢硫酸⑥澄清石灰水.
①品红溶液②氯化钙③酸性高锰酸钾④溴水⑤氢硫酸⑥澄清石灰水.
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑥ | D. | ①③④⑥ |
 ,该化合物是由离子键形成.
,该化合物是由离子键形成.