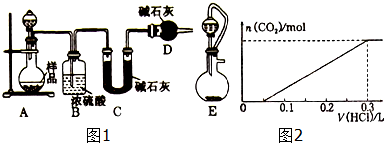
题目内容
10.下列现象或事实可用同一原理解释的是( )| A. | 氯水和二氧化硫使品红溶液褪色 | |
| B. | 稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 | |
| C. | 亚硫酸钠和水玻璃长期暴露在空气中变质 | |
| D. | 浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
分析 A.次氯酸漂白性是因为次氯酸具有强氧化性,二氧化硫漂白,是因为可以和有色物质化合生成无色物质;
B.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子;
C.亚硫酸根具有强的还原性,容易被氧化成硫酸根,硅酸钠能够与空气中的二氧化碳反应;
D.浓盐酸易挥发,浓硫酸具有吸水性.
解答 解:A.氯水使品红溶液褪色是因为有色物质被氧化成无色物质,二氧化硫使品红溶液褪色是因为与有色物质发生化合反应生成无色物质,二者原理不同,故A错误;
B.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子生成单质碘,故B正确;
C.亚硫酸钠被空气中的氧气氧化而变质,水玻璃长期暴露在空气中变质是因为与二氧化碳反应,二者原因不同,故C错误;
D.浓盐酸和浓硫酸长期暴露在空气中浓度变小,原因不同,浓盐酸是因为氯化氢挥发,溶质的物质的量减少,浓硫酸是因为具有吸水性,溶剂增多,故D错误;
故选B.
点评 本题考查了常见无机物质的性质,题目难度不大,熟悉各种物质的性质是解题的关键,注意A选项为易错选项.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列描述中正确的是( )
| A. | 氮原子的价电子排布图: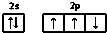 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
1.元素周期表的一部分,针对表中的①…⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的元素是F,(填元素符号);
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为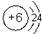 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为
 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
5.X、Y、Z是三种气态物质,在一定温度下其变化符合如图所示.下列说法一定正确的是( )

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
15.下列溶液可用于鉴别CO2与SO2气体的有( )
①品红溶液②氯化钙③酸性高锰酸钾④溴水⑤氢硫酸⑥澄清石灰水.
①品红溶液②氯化钙③酸性高锰酸钾④溴水⑤氢硫酸⑥澄清石灰水.
| A. | ①②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑥ | D. | ①③④⑥ |
2.将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体有沉淀产生.则通入的该气体可能是( )
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
19.下列各装置图的叙述不正确的是( )


| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |
20.相同温度下,容积相同的3个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6-1.实验侧得起始、平衡时的有关数据如表:
下列比较正确的是( )
| 容器编号 | 起始时各物质的物质的量/mol | 达平衡时能量的变化 | |||
| N2 | H2 | NH3 | Ar | ||
| ① | 1 | 3 | 0 | 0 | 放出热量Q1 |
| ② | 0.9 | 2.7 | 0.2 | 0 | 放出热量Q2 |
| ③ | 0.9 | 2.7 | 0.2 | 0.1 | 吸收热量Q3 |
| A. | 放出热量大小:Q1 >Q2 =Q3 | B. | 容器中的压强:③>①=2 | ||
| C. | N2的转化率:①<②<③ | D. | 平衡时NH3的体积分数:①=②<③ |