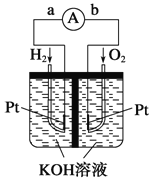
题目内容
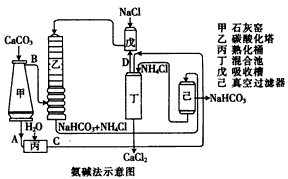
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式为 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是 。

(5)写出由滤液D生成FePO4的离子方程式 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
【答案】(1)+2;
(2)SiO2;
(3)TiOCl42—+ H2O![]() TiO2↓ + 2H+ + 4Cl—
TiO2↓ + 2H+ + 4Cl—
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5)2Fe2++2H3PO4+ H2O2==== 2FePO4↓+2H2O+4H+
(6)20:9
【解析】
试题分析:
(1)FeTiO3可表示为FeO·TiO2所以铁元素为+2价;
(2)矿石中加入盐酸,滤渣为A为SiO2;
(3)结合工业流程,根据质量守恒定律和电荷守恒,可确定反应的离子方程式;
(4)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,结合题意,可知温度过高时,反应物氨水或者双氧水受热易分解,所以反应温度过高时,钛元素浸出率降低;
(5)滤液D含有亚铁离子,与过氧化氢和磷酸反应生成FePO4,结合流程确定反应物和生成物,根据质量守恒定律确定方程式;
(6)分析有D→FePO4→LiFePO4,确定双氧水将Fe2+氧化为Fe3+,H2C2O4再将Fe3+还原为Fe2+,根据电子守恒,所以双氧水与H2C2O4在反应过程中转移了相同数目的电子,因此可得关系H2O2~H2C2O4,设双氧水质量为x,草酸质量为y ,则
H2O2 ~ H2C2O4
34 90
x×17% y
有34:x×17%=90:y 则x:y=20/9。从而确定答案为20:9。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案