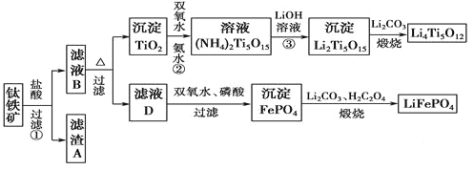
题目内容
【题目】亚氯酸钠(NaClO2)是重要漂白剂。某化学兴趣小组同学展开对亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用下图所示装置进行实验。

(1)装置②中产生ClO2气体的化学方程式为 。
(2)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。过滤用到的玻璃仪器有 。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作是: 。
(4)反应结束后,关闭K2、打开K1,装置①的作用是 ;如果撤去D中的冷水浴,可能导致产品中混有的杂质是 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
【答案】(1)2NaClO3+Na2SO3+H2SO4==2ClO2↑+2Na2SO4+H2O
(2)用38℃~60℃的温水洗涤 烧杯、漏斗、玻璃棒
(3)取晶体少许溶于水,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-。
(4)吸收装置B中多余的ClO2和SO2;NaClO3和NaCl
(5)淀粉溶液;溶液由蓝色变为无色且半分钟不变色
(6)![]() 或
或 ![]()
【解析】
试题分析:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为2NaClO3 + Na2SO3 + H2SO4=2ClO2 + 2Na2SO4 + H2O;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤并用38-60℃的温水洗涤;过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)SO42-的检验方法是加入足量的盐酸酸化,再加BaCl2溶液,根据是否有沉淀判断。故操作是:取晶体少许溶于水,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(4)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,反应结束后,关闭K2、打开K1,装置①的作用是吸收装置B中多余的ClO2和SO2;如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
(5)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
(6)计算时一般找出关系式,由此进行计算,关系式为ClO2-——2I2——4S2O32-
n(ClO2-)= 1/4 n(S2O32-)=1/4×c×V×10-3×4=cV×10-3mol
m(NaClO2)=cV×10-3×90.5
该样品中NaClO2的质量分数为cV×10-3×90.5÷m=![]()

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案