��Ŀ����
����Ŀ����ҵ�����õ������ (��Ҫ����Fe2O3��CuO��Cr2O3��������������������ͭ���Ƚ����������������£�
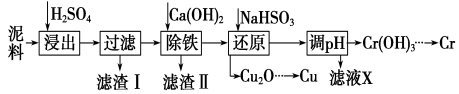
��֪�������ʳ�����pH��CaSO4���ܽ���������£�
��1���ڽ��������г�������Fe2(SO4)3��Cr2(SO4)3�⣬��Ҫ����__________________��
��2���ڳ��������У���Ҫ��ȥFe3����CaSO4���������ز�����
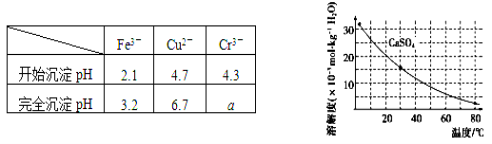
������ʯ�������pH��Լ________������Fe3���Ѿ������IJ�����_________________��
������Һ���ȵ�80����______________________��
��3��д����ԭ�����м���NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽ�� ���˲����м���NaHSO3�õ�Cu2O�IJ���Ϊ95%����NaHSO3�����������˷��Լ��⣬������ֵ�������_______��
��4��������Ũ��С�ڻ����1��10-5mol��L-1ʱ����Ϊ������ȫ����ҪʹCr3����ȫ������Ҫ���� c(OH��)��______��[��֪��Ksp[Cr(OH)3]��6.3��10��31��![]() ��4.0]��
��4.0]��
���𰸡���1��CuSO4 ��2����3.2 ȡ������Һ����KSCN��Һ��������죬��˵��Fe3���ѳ� �����ȹ���
��3��2H2O��HSO3����2Cu2����Cu2O����SO42����5H�� ����SO2����Ⱦ���� ��4��4.0��10-9mol��L-1
��������
�����������1�����������м������ᣬ��������CuO��Cr2O3�������ᷴӦ����������������ͭ������������������������ʣ�����ҺI������������Ҫ��Fe2(SO4)3��Cr2(SO4)3��CuSO4 ��
��2�������������Ϣ�������ṩ�����ݣ��ڢڲ������У�����Ca(OH)2������Һ��pHĿ����ʹFe3���γɳ���������pHֵ�ķ�ΧΪ3.2��pH��4.3�������������Ѿ������IJ�����ȡ������Һ����KSCN��Һ��������죬��˵��Fe3���ѳ���������������ܽ�����¶ȵ���������������˽���Һ���ȵ�80����������ˡ�
��3�����������Ϣ��������ͭ���������Һ�м���NaHSO3������ש��ɫ����˵��ͭԪ�صĻ��ϼ��ɣ�2�۵õ������ɣ�1�۵�Cu2O������Ԫ�ر���ʧ���ӣ����ɣ�6�۵�SO42 ��������������ɫ�̼�����ζ�����壬˵��HSO3�� ��H����Ӧ������SO2 �������NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽΪ2H2O��HSO3�� �� 2Cu2����Cu2O����SO42 ����5H������NaHSO3�����������˷��Լ��⣬������ֵ������Dz���SO2����Ⱦ������
��4��������Ũ�ȡ�1��10��5mol/Lʱ��������Ϊ���ӳ�����ȫ������c(Cr3��)��1��10��5mol/L��c(Cr3��)��c(OH��)3��Ksp[(Cr(OH)3]��6.3��10��31�����c(OH��)��4.0��10��9mol/L��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�