题目内容
【题目】[化学——选修3:物质结构与性质]太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的价电子排布图: 。
(2)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的第二电离能由小到大的顺序为 。(用I2X表示)
(3)气态SeO3分子的杂化类型为 ,与SeO3互为等电子体的一种阴离子为 (填化学式)。
(4)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4 ·H2O,其结构示意图如下:
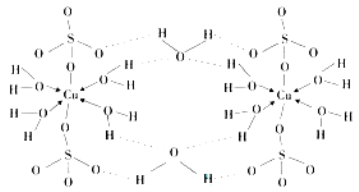
胆矾中含有的粒子间作用力是 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物K 2[Cu(CN)4],该配合物属于 晶体,已知CN-与N2为等电子体,指出1molCN-中![]() 键的数目为 。
键的数目为 。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为 ;若该晶体的晶胞棱长为a nm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏加德罗常数的值为NA)
【答案】(1) 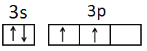 (2分) (2)I2As<I2 Br<I2 Se(2分)
(2分) (2)I2As<I2 Br<I2 Se(2分)
(3)平面三角形 (2分) CO32-或NO3-(2分) (4)ABDE (5)离子晶体,2NA
(6)3:1 (2分) 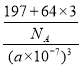 (2分)
(2分)
【解析】
试题分析:(1)硅是14号元素,根据原子核外电子排布规律可知其电子排布式为:1s22s22p63s23p2,因此基态硅原子的价电子排布图为 ;
;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电离能呈增大趋势,但Se元素失去有关电子后4p能级是半满稳定状态,能量较低,第二电离能高于同周期相邻元素,故第二电离能由小到大的顺序为I2As<I2 Br<I2 Se;
(3)气态SeO3分子中中心原子的价层电子对数为![]() =3,无孤电子对,因此分子构型为平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
=3,无孤电子对,因此分子构型为平面三角形;等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;
(4)铜离子和硫酸根离子之间存在离子键,硫原子和氧原子间存在极性共价键,铜原子和氧原子间存在配位键,氧原子和氢原子间存在氢键,答案选ABDE;
(5)在硫酸铜溶液中加入过量KCN,生成配合物K 2[Cu(CN)4],该配合物是由离子构成,因此属于离子胶体,已知CN-与N2为等电子体,说明在CN-中C、N之间存在一个三键,其中有两个π键、一个δ键,所以1molCN-中π键的数目为2NA;
(6)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-7cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
=3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10-7cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=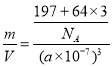 gcm-3。
gcm-3。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
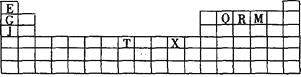

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。